Барий
БАРИЙ (от греч. barys-тяжелый; лат. Barium) Ba, хим. элемент II гр. периодич. системы, ат. н. 56, ат. м. 137,33; относится к щелочноземельным элементам. Прир. Б. состоит из семи стабильных изотопов с мае. ч. 130, 132, 134-137 и 138 (71,66%). Поперечное сечение захвата тепловых нейтронов 1,17-10 28 м2. Конфигурация внеш. электронной оболочки 6s2; степень окисления + 2, редко + 1; энергия ионизации Ва°->Ва+->Ва2+ соотв. 5,21140 и 10,0040 эВ; электроотрицательность по Полингу 0,9; атомный радиус 0,221 нм, ионный радиус Ва2+ 0,149 нм (координационное число 6).
Содержание Б. в земной коре 5-10-2% по массе. В своб. виде не встречается. Важнейшие минералы - барит (тяжелый, или персидский, шпат) BaSO4, наиб, крупные месторождения к-рого находятся в СССР, США, Франции, Румынии, и витерит ВаСО3. Разведанные запасы барита ок. 115 млн. т, общие запасы - ок. 300 млн, т (1980).
Свойства. Б. - серебристо-белый ковкий металл. При резком ударе
раскалывается. При обычном давлении существует в двух аллотропных модификациях:
до 375°С устойчив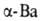 с кубической объемно-центриров. решеткой (а = = 0,501 нм), выше
375 °С устойчив
с кубической объемно-центриров. решеткой (а = = 0,501 нм), выше
375 °С устойчив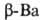 ;
;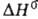 перехода 0,86 кДж/моль. При 19°С и 5530 МПа образуется гексаген, модификация.
Т. пл. 727°С, т. кип. 1637°С; плотн. 3,780 г/см3; тройная точка:
т-ра 710°С, давл. 1,185 Па; ур-ния температурной зависимости давления пара
над твердым и жидким Б. соотв.: 1g р (мм рт. ст.) = 9,405 - 9496/Г --0,787*10-3
T
- 0,3641g T (298-983К), 1gр(мм рт. ст.) = = 20,408 - 8304/Г - 4,036lg T
(983 - 1959 К); tкрит 2497°С; Сp° 28,1 Дж/(моль*К);
перехода 0,86 кДж/моль. При 19°С и 5530 МПа образуется гексаген, модификация.
Т. пл. 727°С, т. кип. 1637°С; плотн. 3,780 г/см3; тройная точка:
т-ра 710°С, давл. 1,185 Па; ур-ния температурной зависимости давления пара
над твердым и жидким Б. соотв.: 1g р (мм рт. ст.) = 9,405 - 9496/Г --0,787*10-3
T
- 0,3641g T (298-983К), 1gр(мм рт. ст.) = = 20,408 - 8304/Г - 4,036lg T
(983 - 1959 К); tкрит 2497°С; Сp° 28,1 Дж/(моль*К);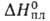 7,12 кДж/моль,
7,12 кДж/моль,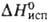 150,9 кДж/моль (1910 К); So298 62,5 Дж/(моль*К);
температурный коэф. линейного расширения (17-21)*10-б К-1
(273-573
Ю;
150,9 кДж/моль (1910 К); So298 62,5 Дж/(моль*К);
температурный коэф. линейного расширения (17-21)*10-б К-1
(273-573
Ю;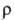 _6*10-8
Ом*м (273 К), температурный коэф.
_6*10-8
Ом*м (273 К), температурный коэф.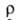 3,6*10-3 К-1. Б. парамагнитен, магн. восприимчивость
0,15*109. Работа выхода электрона 2,49 эВ. Стандартный электродный
потенциал Ва2+/Ва — 2,906 В. Твердость по минералогич. шкале
1,25, по шкале Мооса 2, по Бринеллю 42 МПа; коэф. сжимаемости 10,4*1011
Па-1; 12,8-0,98 МПа (293-873 К).
3,6*10-3 К-1. Б. парамагнитен, магн. восприимчивость
0,15*109. Работа выхода электрона 2,49 эВ. Стандартный электродный
потенциал Ва2+/Ва — 2,906 В. Твердость по минералогич. шкале
1,25, по шкале Мооса 2, по Бринеллю 42 МПа; коэф. сжимаемости 10,4*1011
Па-1; 12,8-0,98 МПа (293-873 К).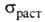
Б. интенсивно окисляется на воздухе, образуя пленку, содержащую бария
оксид ВаО и нитрид Ba3N2 (т. пл. ~ 1000°С). При
незначит. нагревании на воздухе воспламеняется. Энергично реагирует с водой,
давая бария гидроксид Ва(ОН)2. С разб. к-тами образует
соли. Большинство солей Б. с анионами слабых к-т и к-т средней силы малорастворимы,
исключение - BaS, Ba(CN)2, Ba(SCN)2, Ba(OOCCH3)2.
С галогенами Б. образует галогениды, с Н2 при нагр. - гидрид
ВаН2 [т. пл. 675oС (с разл.), плотн. 4,15 г/см3,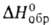 — 190,1 кДж/моль], с NH3 при нагр. - ВаН2 и Ba3N2,
с С и N2 - цианид Ba(CN)2. С жидким NH3
дает темно-синий р-р, из к-рого можно выделить аммиакат [Ba(NH3)6],
имеющий золотистый блеск и легко разлагающийся с отщеплением NH3.
В присут. платинового кат. аммиакат разлагается с образованием амида Б.:
— 190,1 кДж/моль], с NH3 при нагр. - ВаН2 и Ba3N2,
с С и N2 - цианид Ba(CN)2. С жидким NH3
дает темно-синий р-р, из к-рого можно выделить аммиакат [Ba(NH3)6],
имеющий золотистый блеск и легко разлагающийся с отщеплением NH3.
В присут. платинового кат. аммиакат разлагается с образованием амида Б.:
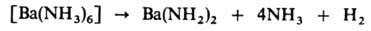
Б. восстанавливает оксиды, галогениды и сульфиды мн. металлов до соответствующего металла. Для него характерно образование интерметаллидов, напр. в системе Ва - А1 обнаружены BaAl, ВаА12, ВаА14.
Наиб. практически важным сое д. Б. (в частности, оксиду, сульфату, фториду, хлориду) посвящены спец. статьи. Ниже приводятся сведения о нек-рых других соед. этого элемента.
Сульфид BaS - бесцв. кристаллы; т. пл. 2200°С; плотн. 4,25 г/см3;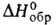 -453 кДж/моль; раств. в воде (в 100г-7,86 г при 20 °С, 67,34 г при 90 °С),
практически не раств. в спирте. Из р-ра кристаллизуется гексагидрат, обезвоживающийся
при 170°С. При растворении BaS частично гидролизуется до Ba(SH)2
и Ва(ОН)2; р-ры медленно окисляются кислородом воздуха с образованием
S. При хранении на воздухе BaS поглощает СО2, образуя ВаСО3
и H2S, при прокаливании на воздухе окисляется до BaSO4.
BaS - промежут. продукт при получении Б. Его применяют в произ-ве ВаС12
и других соед. Б., в кожевенной пром-сти для удаления волосяного покрова
со шкур.
-453 кДж/моль; раств. в воде (в 100г-7,86 г при 20 °С, 67,34 г при 90 °С),
практически не раств. в спирте. Из р-ра кристаллизуется гексагидрат, обезвоживающийся
при 170°С. При растворении BaS частично гидролизуется до Ba(SH)2
и Ва(ОН)2; р-ры медленно окисляются кислородом воздуха с образованием
S. При хранении на воздухе BaS поглощает СО2, образуя ВаСО3
и H2S, при прокаливании на воздухе окисляется до BaSO4.
BaS - промежут. продукт при получении Б. Его применяют в произ-ве ВаС12
и других соед. Б., в кожевенной пром-сти для удаления волосяного покрова
со шкур.
Ацетат Ва(ООССН3), - бесцв. кристаллы; т. пл. 490°С (с разл.); плотн. 2,47 г/см3; раств. в воде (58,8 г в 100 г при 0°С). Ниже 25 °С из водных р-ров кристаллизуется тригидрат, при 25-41 °С - моногидрат, выше 41 °С- безводная соль. Получают взаимод. Ва(ОН)2, ВаСО3 или BaS с СН3СО2Н. Применяют как протраву при крашении шерсти и ситца.
Манганат(VI) ВаМnО4 - зеленые кристаллы; не разлагается до 1000°С. Получают прокаливанием смеси Ba(NO3)2 с МnО2. Пигмент (касселева, или марганцовая, зелень), обычно используемый для фресковой живописи.
Хромат(VI) ВаСrO4 - желтые кристаллы; т. пл. 1380°С;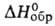 — 1366,8 кДж/моль; раств. в неорг. к-тах, не раств. в воде. Получают взаимод.
водных р-ров Ва(ОН)2 или BaS с хроматами(VI) щелочных металлов.
Пигмент (баритовый желтый) для керамики. ПДК 0,01 мг/м3 (в пересчете
на Сг03). Пирконат ВаZrО3-бесцв. кристаллы; т. пл.
~269°С;
— 1366,8 кДж/моль; раств. в неорг. к-тах, не раств. в воде. Получают взаимод.
водных р-ров Ва(ОН)2 или BaS с хроматами(VI) щелочных металлов.
Пигмент (баритовый желтый) для керамики. ПДК 0,01 мг/м3 (в пересчете
на Сг03). Пирконат ВаZrО3-бесцв. кристаллы; т. пл.
~269°С;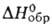 - 1762 кДж/моль; раств. в воде и водных р-рах щелочей и NH4HCO3,
разлагается сильными неорг. к-тами. Получают взаимод. ZrO2 с
ВаО, Ва(ОН)2 или ВаСО3 при нагревании. Цирконат Ва
в смеси с ВаТiO3-пьезоэлект-рик.
- 1762 кДж/моль; раств. в воде и водных р-рах щелочей и NH4HCO3,
разлагается сильными неорг. к-тами. Получают взаимод. ZrO2 с
ВаО, Ва(ОН)2 или ВаСО3 при нагревании. Цирконат Ва
в смеси с ВаТiO3-пьезоэлект-рик.
Бромид ВаВr2 - белые кристаллы; т. пл. 847°С; плотн. 4,79
г/см3;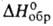 -757 кДж/моль; хорошо раств. в воде, метаноле, хуже - в этаноле. Из водных
р-ров кристаллизуется дигидрат, превращающийся в моногидрат при 75°С, в
безводную соль - выше 100°С В водных р-рах взаимод. с СО2 и
О2 воздуха, образуя ВаСО3 и Вr2. Получают
ВаВr2 взаимод. водных р-ров Ва(ОН)2 или ВаСО3
с бромистоводородной к-той.
-757 кДж/моль; хорошо раств. в воде, метаноле, хуже - в этаноле. Из водных
р-ров кристаллизуется дигидрат, превращающийся в моногидрат при 75°С, в
безводную соль - выше 100°С В водных р-рах взаимод. с СО2 и
О2 воздуха, образуя ВаСО3 и Вr2. Получают
ВаВr2 взаимод. водных р-ров Ва(ОН)2 или ВаСО3
с бромистоводородной к-той.
Иодид ВаI2 - бесцв. кристаллы; т. пл. 740°С (с разл.); плотн.
5,15 г/см3;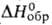 . -607 кДж/моль; хорошо раств. в воде и этаноле. Из горячих водных р-ров
кристаллизуется дигидрат (обезвоживается при 150°С), ниже 30 °С - гексагидрат.
Получают ВаI2 взаимод. водных р-ров Ва(ОН)2 или ВаСО3
с иодистоводородной к-той.
. -607 кДж/моль; хорошо раств. в воде и этаноле. Из горячих водных р-ров
кристаллизуется дигидрат (обезвоживается при 150°С), ниже 30 °С - гексагидрат.
Получают ВаI2 взаимод. водных р-ров Ва(ОН)2 или ВаСО3
с иодистоводородной к-той.
Получение. Осн. сырье в произ-ве Б. и его соед. -баритовый концентрат (80-95% BaSO4), к-рый получают флотацией барита с использованием жидкого стекла в кач-ве депрессора пустой породы; степень извлечения BaSO4 - 55-60%. Восстановлением BaSO4 каменным углем, коксом или прир. газом получают BaS (BaSO4 + 4С -> BaS + 4СО; BaSO4 + 2СН4 -> BaS + 2С + 4Н2О), к-рый перерабатывают на другие соед. Б., в частности Ва(ОН)2, ВаСО3 и Ba(NO3)2. Прокаливанием этих соединений соотв. при 800, 1400 и 700 °С получают ВаО.
Осн. пром. метод получения металлич. Б. из ВаО - восстановление его порошком А1: 4ВаО + 2А1 -> ЗВа + ВаО*А12О3. Процесс проводят в реакторе при 1100-1200 °С в атмосфере Аг или в вакууме (последний способ предпочтителен). Молярное соотношение ВаО:А1 составляет (1,5-2):1. Реактор помещают в печь так, чтобы т-ра его "холодной части" (в ней конденсируются образующиеся пары Б.) была ок. 520°С Перегонкой в вакууме Б. очищают до содержания примесей менее 10~4% по массе, а при использовании зонной плавки - до 10~6%.
Небольшие кол-ва Б. получают также восстановлением ВаВеО2 [синтезируемого сплавлением Ва(ОН)2 и Ве(ОН)2] при 1300°С титаном, а также разложением при 120°С Ba(N3)2, образующегося при обменных р-циях солей Б. с NaN3.
Определение. Из водных р-ров солей Б. осаждается вместе с Са и Sr при
действии (NH4)2CO3. От Са и Sr барий отделяют
в виде ВаСrO4 в присут. СН3СО2Н либо в
виде BaSO4 благодаря его очень низкой р-римости в неорг. к-тах.
Обнаруживают Б. по желто-зеленому окрашиванию пламени (длина волны 455
и 493 нм) и по розовому окрашиванию р-ра родизоната Na. Количественно Б.
определяют гравиметрически в виде BaSO4 [осадители - H2SO4,
(NH4)2S04, H2NS02OH,
(CH3)2SOJ, в присут. Са и Sr-в виде ВаСrO4
(получаемого осаждением К2Сr2О7 из уксуснокислых
р-ров). Б. определяют также титриметрически с применением комплексона III
при рН 10 и эриохрома черного Т в кач-ве индикатора и фотометрически с
использованием ортонилового С при рН 2-8 в водно-спиртовом или водно-ацетоновом
р-ре (длина волны окрашенного комплекса 640 нм). Для экспресс-анализа прир.
минералов, руд и др. используют рентгенофлуоресцентный метод (источники излучения
- 170Тm, 241Ат с активностью 5-6 Кюри; эмиссионная
линия Б.
излучения
- 170Тm, 241Ат с активностью 5-6 Кюри; эмиссионная
линия Б.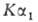 при 0,386 °С).
при 0,386 °С).
Применение. Сплав Б. с А1 (сплав альба, 56% Ва) - основа геттеров (газопоглотителей). Для получения собственно геттера Б. испаряют из сплава высокочастотным нагревом в вакуумированной колбе прибора, в результате на холодных частях колбы образуется т. наз. бариевое зеркало (или диффузное покрытие при испарении в среде азота). Активной частью подавляющего большинства термоэмиссионных катодов является ВаО. Б. используют также как раскислитель Си и Рb, в кач-ве присадки к антифрикц. сплавам, черным и цветным металлам, а также к сплавам, из к-рых изготавливают типографские шрифты для увеличения их твердости. Сплавы Б. с Ni служат для изготовления электродов запальных свечей в двигателях внутр. сгорания и в радиолампах. 140Ва (T1/2 12,8 дней) - изотопный индикатор, используемый при исследовании соединений Б.
Мировое произ-во (без СССР) барита 7,3 млн. т, др. соед. Ва - 0,70-0,75 млн. т (1980). Металлич. Б. хранят в керосине, под слоем парафина, сплавы - в герметичной металлич. упаковке в атмосфере азота. Б. открыт в виде ВаО в 1774 К. Шееле, металлич. Б. впервые получен в 1808 Г. Дэви.
Лит.: АхметовТ.Г., Химия и технология соединений бария М., 1974;
Фрумина Н. С., Горюнова Н. Н., Еременко С. Н., Аналитическая химия бария,
М., 1977. Н.А.Иофис. Б. Г. Иофис.

