Кондуктометрия
Контактные методы. Измерения проводят с помощью контактных ячеек (рис.1, а). При этом используют электроды из Pt, Ti, нержавеющей стали и др. Для измерения х р-ров с высокой концентрацией электролита (10-2-10-3 М) применяют платинированные электроды с развитой пов-стью.
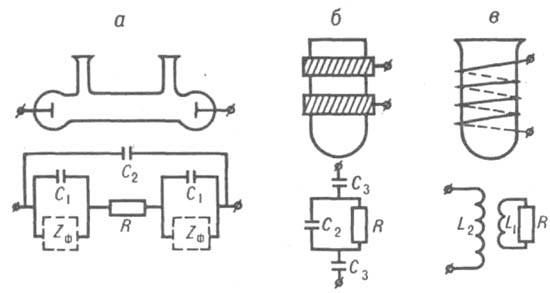
Рис. 1. Кондуктометрич. ячейки и их эквивалентные электрич. схемы: a-контактная ячейка; б-емкостная ячейка; в-индуктивная ячейка; R-сопротивление электролита; С1-емкость двойного электрич. слоя на межфазной границе электрод - электролит; С2-емкость р-ра; С3-емкость конденсатора, образованного р-ром, стенкой ячейки и внеш. электродом; Zф-фарадеевский импеданс, связанный с протекающей на границе электрод-электролит электрохим. р-цией; L1 и L2-индуктивности соотв. электролита и катушки.
Впрямой К. непосредственно определяют концентрацию электролита по ( его р-ра (если между этими величинами имеется линейная зависимость). Метод применяется гл. обр. для анализа разб. р-ров. В случае концентрир. р-ров необходимо строить градуировочные графики. Определение в-в в присут. других электролитов возможно, если концентрации последних постоянны. На методе прямой К. основаны конструкции солемеров и др. кондуктометрич. устройств, позволяющих определять олеум, а также разл. соли в минеральной, речной и морской водах, физиол. жидкостях и др. Прямую К. применяют при контроле регенерации ионитов, очистки воды, промывки осадков, при оценке качества вин, соков и др. напитков, чистоты орг. р-рителей, газов, твердых солей, текстильных материалов, бумаги, зерна, почвы и т.д. Часто анализируемые образцы
предварительно сжигают, а выделяющиеся газы поглощают подходящими р-рами. По электропроводности поглотителей определяют кол-ва газов (в частности, СО2, NO2, SO2), следовательно-содержание соответствующих элементов, напр. С, N, S, в металлах, сплавах и орг. соединениях.
В косвенной К., позволяющей исследовать смеси электролитов, наряду с электропроводностью р-ров измеряют рефракцию, вязкость, рН, плотность или др. величины. Напр., при анализе пром. нитрующих смесей, содержащих H2SO4, HNO3 и Н2О, дополнительно измеряют плотность. По совокупности всех эксперим. данных определяют количеств, состав смеси.
Кондуктометрическое титрование (К.т.) основано на изменении х р-ра при хим. р-циях, связанном с изменением концентрации ионов разл. подвижности. К. т. проводят в водных, водно-орг. и неводных средах. Кривые титрования, представляющие собой зависимость х от кол-ва прибавленного реагента (титранта), имеют излом в точке эквивалентности. При титровании смесей электролитов число изломов равно числу определяемых компонентов, взаимодействующих с титрантом. Форма кривых м.б. разной (рис. 2).
К. т. может быть основано на разл. р-циях. наиб. широко используются кислотно-основные взаимодействия. Так, разработаны методы определения в воде к-т и оснований с
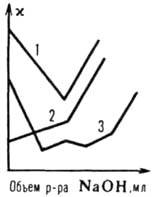
Рис. 2. Кривые кондуктометрич. титрования в контактной ячейке р-ром NaOH: 1 - соляной к-ты; 2 - CH3COOH; 3 - смеси HCl+СН3СООН+(C2H5)3N.НCl+фенол.
рК[10, солей слабых к-т или оснований. При титровании сильными основаниями сильных или слабых к-т х до точки эквивалентности соответственно понижается (т.к. высокоподвижные ионы Н+ заменяются менее подвижными катионами титранта) или увеличивается (в результате диссоциации соли). При избытке сильного основания после точки эквивалентности ( резко увеличивается (рис. 2, кривые 1 и 2). При титровании солей ( до точки эквивалентности сравнительно мало изменяется, т. к. подвижности заменяющих друг друга ионов близки. Поэтому возможен анализ смесей солей с к-тами или основаниями, содержащих от 2 до 5 компонентов (рис. 2, кривая 3). При К. т., основанном на комплексообразовании, катионы (напр., Fe3+ , Cu2+, Рb2+, РЗЭ) титруют этилендиаминтетраацетатом Na, а также тартрат-, оксалат-, цитрат-, цианид-ионами и др. Р-ции осаждения применяют для кондуктометрич. определения как анионов, так и катионов. Напр., р-ром AgNO3 оттитровывают Сl-, Вr-, I-, CN-; р-ром Ва(ОСОСН3)2 или ВаСl2-SO2-, Сr42-; р-ром Th(NO3)3-F-, SiF62-; р-ром Na2SeO3-Mn2+, Co2+ . Методы К. т., основанные на р-циях окисления-восстановления, используются редко.
При т. наз. хронокондуктометрич. титровании р-р титранта подается в реакц. сосуд (электрохим. ячейку) с постоянной скоростью, так что время титрования пропорционально кол-ву прибавленного титранта. Концентрации в-в определяют по кривым "электропроводность р-ра - время титрования". Обычно осуществляется автоматич. запись кривых. Все определения, проводимые обычным К. т., могут быть осуществлены хронокондуктометрически.
Контактные методы отличаются высокой точностью. Они применяются не только для хим. анализа, но и для изучения кинетики р-ций, определения констант диссоциации (ассоциации) электролитов, р-римости осадков, коэф. диффузии и т.д.
Бесконтактные методы. Применяются для относительных измерений электропроводности, гл. обр. для высокочастотного
титрования. Измерения проводят с применением емкостных (С-) или индуктивных (L-) ячеек, представляющих собой сосуды из диэлектрика, к-рые соответственно имеют с внеш. стороны не менее двух металлич. электродов (рис. 1,б) или помещены в магн. поле катушки индуктивности (рис. 1,в). Электроды С-ячейки или катушка индуктивности соединяются с высокочастотным генератором. Электропроводность электролита при токе высокой частоты обусловлена не только реальным перемещением зарядов, но в большей мере потерями электрич. энергии в емкостной и индуктивных ячейках. Это отражается на реактивной составляющей X полного сопротивления (импеданса) цепи Z2 = R2 + X2, где R-активное сопротивление, X=XL-ХC, XL и ХC - соотв. индуктивное и емкостное сопротивление цепи. Индуктивные ячейки используют обычно для измерения сравнительно высокой электропроводности, а емкостные - для измерения низкой электропроводности. Чувствительность измерения повышается в С-ячейках при использовании диэлектриков с высокой диэлектрич. проницаемостью, уменьшении толщины стенок сосуда и увеличении площади электродов, а в L-ячейках - с увеличением объема пробы. Применяются также комбинированные LC-ячейки, RC- и RL-ячейки с повыш. чувствительностью, а также многозвенные ячейки с разл. числом электродов, включенных в фазовращающие контуры автоколебат. генераторов. При высокочастотном титровании необходимо предварительно выбирать условия с учетом характеристич. кривой ячейки, т.е. зависимости 1/XL или 1/ХC от х (рис. 3). Чем больше интервал между значениями (:0 и (::, в к-ром эта зависимость линейна, тем удобнее ячейка для измерений. Кроме того, чувствительность измерений различна на разл. участках характеристич. кривой; напр., в случае кривой 1 чувствительность наименьшая в максимуме и наибольшая в точках перегиба.
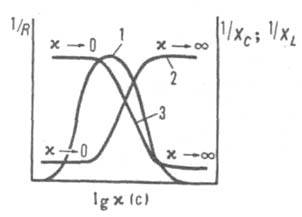
Рис. 3. Характеристич. кривые бесконтактных высокочастотных ячеек: 1,2,3 - зависимости обратных величин соотв. активной, емкостной и индуктивной составляющих Z от lg(.
Кривые высокочастотного титрования имеют минимум (как кривая 1 на рис. 2) или максимум, а также могут представлять собой М-образные кривые. Бесконтактные методы уступают контактным по точности, но превосходят их по чувствительности. Кроме того, из-за отсутствия взаимодействия материала электрода с исследуемой средой эти методы позволяют проводить измерения при высоких и низких т-рах, в агрессивных средах, в замкнутых объемах. Они применяются для кислотно-основных титрований на фоне дифференцирующих р-рителей (СН3СООН, ацетон, диоксан и др.), детектирования в-в в хроматографии, экспресс-анализа орг. соед., воздуха и пром. газов, анализа хим. реактивов, контроля качества лек. ср-в в запаянных ампулах, для изучения комплексообразования, гидролиза, сольватации, фазовых переходов. Лит.: Худякова Т. А., Крешков А. П., Теория и практика кондуктометрического и хронокондуктометрического анализа, М., 1976; Лопатин Б. А., Высокочастотное титрование с многозвенными ячейками, М., 1980; Грилихес М.С., Филановский Б. К., Контактная кондуктометрия, Л., 1980. Т. А. Худякова. Б. К. Филановский. М.С. Грилихес.

