Словарь научных терминов
Кислород
КИСЛОРОД (лат Oxygenium, от греч. oxys кислый и gennao - рождаю) О, хим. элемент VI гр. периодич. системы, ат. н. 8, ат. м. 15,9994. Прир. К. состоит из трех стабильных изотопов: 16О (99,759%), 17О (0,037%) и 18О (0,204%]. Конфигурация внеш. электронной оболочки атома 2s22p; энергии ионизации О°:О+:О2+ равны соотв. 13,61819, 35,118 эВ; электроотрицательность по Полингу 3,5 (наиб. электроотрицат. элемент после F); сродство к электрону 1,467 эВ; ковалентный радиус 0,066 нм.
Молекула К. двухатомна. Существует также аллотропная модификация К. озон О3. Межатомное расстояние в молекуле О2 0,12074 нм; энергия ионизации О2 12,075 эВ;
сродство к электрону 0,44 эВ; энергия диссоциации 493,57 кДж/моль, константа диссоциации Кр=pO2/pO2 составляет 1,662.10-1 при 1500 К, 1,264.10-2 при 3000 К, 48,37 при 5000 К; ионный радиус О2 (в скобках указаны координац. числа) 0,121 нм (2), 0,124 нм (4), 0,126 нм (6) и 0,128 нм (8).
В основном состоянии (триплетное 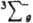 ) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему К. парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное
) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему К. парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное 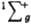 (энергия возбуждения 156,8 кДж/моль).
К.-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. К., в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного К. Известно более 1400 минералов, в состав к-рых входит К. Убыль К. в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением К. растениями при фотосинтезе. К. входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%.
Свойства. К.-бесцв. газ без запаха и вкуса. Т. кип. 90,188 К, т-ра тройной точки 54,361 К; плотн. при 273 К и нормальном давлении 1,42897 г/л, плотн. (в кг/м3) при 300 К: 6,43 (0,5 МПа), 12,91 (1 МПа), 52,51 (4 МПа); tкрит 154,581 К, ркрит 5.043 МПа, dкрит 436,2 кг/м3; С0p 29,4 Дж/(моль.К); DH0исп 6,8 кДж/моль (90,1 К); SO299 205,0 ДжДмоль.К); ур-ние температурной зависимости давления пара: в интервале 54-150 К lgp(гПа)=7,1648-377,153/T; теплопроводность 0,02465 Вт/(м.К) при 273 К; h 205,23 10-7 Па.с (298 К).
Жидкий К. окрашен в голубой цвет; плотн. 1,14 г/см3 (90,188 К); COp 54,40 Дж/(моль.К); теплопроводность 0,147 ВтДм.К) (90 К, 0,1 МПа); h 1,890.10-2 Па.с; g 13,2.10-5 Н/м (90 К), ур-ние температурной зависимости g=-38,46.10-3(1 - T/154,576)11/9 Н/м; nD 1,2149 (l=546,1 нм; 100 К); неэлектропроводен; молярная магн. восприимчивость 7,699.10-3 (90,1 К).
Твердый К. существует в неск. кристаллич. модификациях. Ниже 23,89 К устойчива а-форма с объемноцентрир. ром-бич, решеткой (при 21 К и 0,1 МПа а = 0,55 нм, b= 0,382 нм, с=0,344 нм, плотн. 1,46 г/см3), при 23,89-43,8 К-b-форма с гексаген, кристаллич. решеткой (при 28 К и 0,1 МПа а = 0,3307 нм, с = 1,1254 нм), выше 43,8 К существует g-форма с кубич. решеткой (а = 0,683 нм); DH° полиморфных переходов g:b 744 Дж/моль (43,818 К), b:a 93,8 Дж/моль (23,878 К); тройная точка b-g-газообразный К.: т-ра 283 К, давление 5,0 ГПа; DHOпл 443 Дж/молъ; ур-ние температурной зависимости плотности d=1,5154-0,004220T г/см3 (44 54 К), a-, b- и g- О2 кристаллы светло-синего цвета. Модификация р антиферромагнитна, a и g парамагнитны, их магн. восприимчивость соотв. 1,760.10-3 (23,7 К) и 1,0200.10-5 (54,3 К). При 298 К и повышении давления до 5,9 ГПа К. кристаллизуется, образуя окрашенную в розовый цвет гексаген. b-форму (а = 0,2849 нм, с = 1,0232 нм), а при повышении давления до 9 ГПа оранжевую ромбич. e-форму (при 9,6 ГПа а=0,42151 нм, b=0,29567 нм, с=0,66897 нм, плотн. 2,548 г/см3).
Р-римость К. при атм. давлении и 293 К (в см3/см3): в воде 0,031, этаноле 0,2201, метаноле 0,2557, ацетоне 0,2313; р-римость в воде при 373 К 0,017 см3/см3; р-римость при 274 К (в % по объему): в перфторбутилтетрагидрофуране 48,5, перфтордекалине 45,0, перфтор-l-метилдекалине 42,3. Хорошие твердые поглотители К. платиновая чернь и активный древесный уголь. Благородные металлы в расплавл. состоянии поглощают значит. кол-ва К., напр. при 960 °С один объем серебра поглощает ~22 объема К., к-рый при
охлаждении почти полностью выделяется. Способностью поглощать К. обладают мн. твердые металлы и оксиды, при этом образуются нестехиометрич. соединения.
К. отличается высокой хим. активностью, образуя соед. со всеми элементами, кроме Не, Ne и Аr. Атом К. в хим. соед. обычно приобретает электроны и имеет отрицат. эффективный заряд. Соед., в к-рых электроны оттягиваются от атома К., крайне редки (напр., OF2). С простыми в-вами, кроме Au, Pt, Xe и Кr, К. реагирует непосредственно при обычных условиях или при нагр., а также в присут. катализаторов. Р-ции с галогенами проходят под действием электрич. разряда или УФ излучения. В р-циях со всеми простыми в-вами, кроме F2, К. является окислителем.
Мол. К. образует три разл. ионные формы, каждая из к-рых дает начало классу соед.: О-2 - супероксидам, О22- - пeроксидам (см. Пероксидные соединения неорганические, Пе-роксидные соединения органические), О+2 - диоксигенильным соeдинениям. Озон образует озониды, в к-рых ионная форма К.-О-3. Молекула О2 присоединяется как слабый лиганд к нек-рым комплексам Fe, Co, Мn, Сu. Среди таких соед. важное значение имеет гемоглобин, к-рый осуществляет перенос К. в организме теплокровных.
Р-ции с К., сопровождающиеся интенсивным выделением энeргии, наз. горением. Большую роль играют взаимод. К. с металлами в присут. влаги-атм. коррозия металлов, а также дыхание живых организмов и гниение. В результате гниения сложные орг. в-ва погибших животных и растений превращаются в более простые и в конечном счете в СО2 и волу.
С водородом К. реагирует с образованием воды и выделением большого кол-ва тепла (286 кДж на моль Н2). При комнатной т-ре р-ция идет крайне медленно, в присут. катализаторов - сравнительно быстро уже при 80-100 °С (эту р-цию используют для очистки Н2 и инертных газов от примеси О2). Выше 550 °С р-ция Н2 с О2 сопровождается взрывом.
Из элементов I гр. наиб. легко реагируют с К. Rb и Cs, к-рые самовоспламеняются на воздухе, К, Na и Li реагируют с К. медленнее, р-ция ускоряется в присут. паров воды. При сжигании щелочных металлов (кроме Li) в атмосфере К. образуются пероксиды М2О2 и супероксиды МО2. С элементами подгруппы IIа К. реагирует сравнительно легко, напр., Ва способен воспламеняться на воздухе при 20-25°С, Mg и Be воспламеняются выше 500 °С; продукты р-ции в этих случаях - оксиды и пероксиды. С элементами подгруппы IIб К. взаимод. с большим трудом, р-ция К. с Zn, Cd и Hg происходит только при более высоких т-рах (известны породы, в к-рых Hg содержится в элементарной форме). На пов-стях Zn и Cd образуются прочные пленки их оксидов, предохраняющие металлы от дальнейшего окисления.
Элементы III гр. реагируют с К. только при нагр., образуя оксиды. Компактные металлы Ti, Zr, Hf устойчивы к действию К. С углеродом К. реагирует с образованием СО2 и выделением тепла (394 кДж/моль); с аморфным углеродом р-ция протекает при небольшом нагревании, с алмазом и графитом - выше 700 °С.
С азотом К. реагирует лишь выше 1200°С с образованием NO, к-рый далее легко окисляется К. до NO2 уже при комнатной т-ре. Белый фосфор склонен к самовозгоранию на воздухе при комнатной т-ре.
Элементы VI гр. S, Se и Те реагируют с К. с заметной скоростью при умеренном нагревании. Заметное окисление W и Мо наблюдается выше 400 °С, Cr - при значительно более высокой т-ре.
К. энергично окисляет орг. соединения. Горение жидких топлив и горючего газа происходит в результате р-ции К. с углеводородами.
(энергия возбуждения 156,8 кДж/моль).
К.-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. К., в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного К. Известно более 1400 минералов, в состав к-рых входит К. Убыль К. в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением К. растениями при фотосинтезе. К. входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%.
Свойства. К.-бесцв. газ без запаха и вкуса. Т. кип. 90,188 К, т-ра тройной точки 54,361 К; плотн. при 273 К и нормальном давлении 1,42897 г/л, плотн. (в кг/м3) при 300 К: 6,43 (0,5 МПа), 12,91 (1 МПа), 52,51 (4 МПа); tкрит 154,581 К, ркрит 5.043 МПа, dкрит 436,2 кг/м3; С0p 29,4 Дж/(моль.К); DH0исп 6,8 кДж/моль (90,1 К); SO299 205,0 ДжДмоль.К); ур-ние температурной зависимости давления пара: в интервале 54-150 К lgp(гПа)=7,1648-377,153/T; теплопроводность 0,02465 Вт/(м.К) при 273 К; h 205,23 10-7 Па.с (298 К).
Жидкий К. окрашен в голубой цвет; плотн. 1,14 г/см3 (90,188 К); COp 54,40 Дж/(моль.К); теплопроводность 0,147 ВтДм.К) (90 К, 0,1 МПа); h 1,890.10-2 Па.с; g 13,2.10-5 Н/м (90 К), ур-ние температурной зависимости g=-38,46.10-3(1 - T/154,576)11/9 Н/м; nD 1,2149 (l=546,1 нм; 100 К); неэлектропроводен; молярная магн. восприимчивость 7,699.10-3 (90,1 К).
Твердый К. существует в неск. кристаллич. модификациях. Ниже 23,89 К устойчива а-форма с объемноцентрир. ром-бич, решеткой (при 21 К и 0,1 МПа а = 0,55 нм, b= 0,382 нм, с=0,344 нм, плотн. 1,46 г/см3), при 23,89-43,8 К-b-форма с гексаген, кристаллич. решеткой (при 28 К и 0,1 МПа а = 0,3307 нм, с = 1,1254 нм), выше 43,8 К существует g-форма с кубич. решеткой (а = 0,683 нм); DH° полиморфных переходов g:b 744 Дж/моль (43,818 К), b:a 93,8 Дж/моль (23,878 К); тройная точка b-g-газообразный К.: т-ра 283 К, давление 5,0 ГПа; DHOпл 443 Дж/молъ; ур-ние температурной зависимости плотности d=1,5154-0,004220T г/см3 (44 54 К), a-, b- и g- О2 кристаллы светло-синего цвета. Модификация р антиферромагнитна, a и g парамагнитны, их магн. восприимчивость соотв. 1,760.10-3 (23,7 К) и 1,0200.10-5 (54,3 К). При 298 К и повышении давления до 5,9 ГПа К. кристаллизуется, образуя окрашенную в розовый цвет гексаген. b-форму (а = 0,2849 нм, с = 1,0232 нм), а при повышении давления до 9 ГПа оранжевую ромбич. e-форму (при 9,6 ГПа а=0,42151 нм, b=0,29567 нм, с=0,66897 нм, плотн. 2,548 г/см3).
Р-римость К. при атм. давлении и 293 К (в см3/см3): в воде 0,031, этаноле 0,2201, метаноле 0,2557, ацетоне 0,2313; р-римость в воде при 373 К 0,017 см3/см3; р-римость при 274 К (в % по объему): в перфторбутилтетрагидрофуране 48,5, перфтордекалине 45,0, перфтор-l-метилдекалине 42,3. Хорошие твердые поглотители К. платиновая чернь и активный древесный уголь. Благородные металлы в расплавл. состоянии поглощают значит. кол-ва К., напр. при 960 °С один объем серебра поглощает ~22 объема К., к-рый при
охлаждении почти полностью выделяется. Способностью поглощать К. обладают мн. твердые металлы и оксиды, при этом образуются нестехиометрич. соединения.
К. отличается высокой хим. активностью, образуя соед. со всеми элементами, кроме Не, Ne и Аr. Атом К. в хим. соед. обычно приобретает электроны и имеет отрицат. эффективный заряд. Соед., в к-рых электроны оттягиваются от атома К., крайне редки (напр., OF2). С простыми в-вами, кроме Au, Pt, Xe и Кr, К. реагирует непосредственно при обычных условиях или при нагр., а также в присут. катализаторов. Р-ции с галогенами проходят под действием электрич. разряда или УФ излучения. В р-циях со всеми простыми в-вами, кроме F2, К. является окислителем.
Мол. К. образует три разл. ионные формы, каждая из к-рых дает начало классу соед.: О-2 - супероксидам, О22- - пeроксидам (см. Пероксидные соединения неорганические, Пе-роксидные соединения органические), О+2 - диоксигенильным соeдинениям. Озон образует озониды, в к-рых ионная форма К.-О-3. Молекула О2 присоединяется как слабый лиганд к нек-рым комплексам Fe, Co, Мn, Сu. Среди таких соед. важное значение имеет гемоглобин, к-рый осуществляет перенос К. в организме теплокровных.
Р-ции с К., сопровождающиеся интенсивным выделением энeргии, наз. горением. Большую роль играют взаимод. К. с металлами в присут. влаги-атм. коррозия металлов, а также дыхание живых организмов и гниение. В результате гниения сложные орг. в-ва погибших животных и растений превращаются в более простые и в конечном счете в СО2 и волу.
С водородом К. реагирует с образованием воды и выделением большого кол-ва тепла (286 кДж на моль Н2). При комнатной т-ре р-ция идет крайне медленно, в присут. катализаторов - сравнительно быстро уже при 80-100 °С (эту р-цию используют для очистки Н2 и инертных газов от примеси О2). Выше 550 °С р-ция Н2 с О2 сопровождается взрывом.
Из элементов I гр. наиб. легко реагируют с К. Rb и Cs, к-рые самовоспламеняются на воздухе, К, Na и Li реагируют с К. медленнее, р-ция ускоряется в присут. паров воды. При сжигании щелочных металлов (кроме Li) в атмосфере К. образуются пероксиды М2О2 и супероксиды МО2. С элементами подгруппы IIа К. реагирует сравнительно легко, напр., Ва способен воспламеняться на воздухе при 20-25°С, Mg и Be воспламеняются выше 500 °С; продукты р-ции в этих случаях - оксиды и пероксиды. С элементами подгруппы IIб К. взаимод. с большим трудом, р-ция К. с Zn, Cd и Hg происходит только при более высоких т-рах (известны породы, в к-рых Hg содержится в элементарной форме). На пов-стях Zn и Cd образуются прочные пленки их оксидов, предохраняющие металлы от дальнейшего окисления.
Элементы III гр. реагируют с К. только при нагр., образуя оксиды. Компактные металлы Ti, Zr, Hf устойчивы к действию К. С углеродом К. реагирует с образованием СО2 и выделением тепла (394 кДж/моль); с аморфным углеродом р-ция протекает при небольшом нагревании, с алмазом и графитом - выше 700 °С.
С азотом К. реагирует лишь выше 1200°С с образованием NO, к-рый далее легко окисляется К. до NO2 уже при комнатной т-ре. Белый фосфор склонен к самовозгоранию на воздухе при комнатной т-ре.
Элементы VI гр. S, Se и Те реагируют с К. с заметной скоростью при умеренном нагревании. Заметное окисление W и Мо наблюдается выше 400 °С, Cr - при значительно более высокой т-ре.
К. энергично окисляет орг. соединения. Горение жидких топлив и горючего газа происходит в результате р-ции К. с углеводородами.
Получение. В пром-сти К. получают воздуха разделением, гл. обр. методом низкотемпературной ректификации. Его производят также наряду с Н2 при пром. электролизе воды. Выпускают газообразный технол. К. (92-98% О2), техн. (1-й сорт 99,7% О2, 2-й сорт 99,5% и 3-й сорт 99,2%) и жидкий (не менее 99,7% О2). Производится также К. для лечебных целей ("медицинский кислород", содержащий 99,5% O2). Для дыхания в замкнутых помещениях (подводные лодки, космич. аппараты и др.) используют твердые источники К., действие к-рых основано на самораспространяющейся экзо-термич. р-ции между носителем К. (хлоратом или перхлоратом) и горючим. Напр., смесь NaClO3 (80%), порошка Fe (10%), ВаО2 (4%) и стекловолокна (6%) прессуют в виде цилиндров; после поджигания такая кислородная свеча горит со скоростью 0,15-0,2 мм/с, выделяя чистый, пригодный для дыхания К. в кол-ве 240 л/кг (см. Пиротехнические источники газов). В лаборатории К. получают разложением при нагр. оксидов (напр., HgO) или кислородсодержащих солей (напр., КСlO3, КМnО4), а также электролизом водного р-ра NaOH. Однако чаще всего используют пром. К., поставляемый в баллонах под давлением.
Определение. Концентрацию К. в газах определяют с помощью ручных газоанализаторов, напр. волюмометрич. методом по изменению известного объема анализируемой пробы после поглощения из нее О2 р-рами - медноаммиачным, пирогаллола, NaHSO3 и др. Для непрерывного определения К. в газах применяются автоматич. термомагн. газоанализаторы, основанные на высокой магн. восприимчивости К. Для определения малых концентраций К. в инертных газах или водороде (менее 1%) используют автоматич. термохим., электрохим., гальванич. и др. газоанализаторы. С этой же целью применяют колориметрич. метод (с использованием прибора Мугдана), основанный на окислении бесцв. аммиачного комплекса Cu(I) в яркоокра-шенное соед. Cu(II). К., растворенный в воде, определяют также колориметрически, напр. по образованию красного окрашивания при окислении восстановленного индигокар-мина. В орг. соед. К. определяют в виде СО или СО2 после высокотемпературного пиролиза анализируемого в-ва в потоке инертного газа. Для определения концентрации К. в стали и сплавах используют электрохим. датчики с твердым электролитом (стабилизированный ZrO2). См. также Газовый анализ, Газоанализаторы.
Применение. К. используют как окислитель: в металлургии - при выплавке чугуна и стали (в доменном, кислородно-конвертерном и мартеновском произ-вах), в процессах шахтной, взвешенной и конвертерной плавки цветных металлов; в прокатном произ-ве; при огневой зачистке металлов; в литейном произ-ве; при термитной сварке и резке металлов; в хим. и нефтехим. пром-сти-при произ-ве HNO3, H2SO4, метанола, ацетилена; формальдегида, оксидов, пероксидов и др. в-в. К. используют в лечебных целях в медицине, а также в кислородно-дыхат. аппаратах (в космич. кораблях, на подводных судах, при высотных полетах, подводных и спасательных работах). Жидкий К.-окислитель для ракетных топлив; его используют также при взрывных работах, как хладагент в лаб. практике. Произ-во К. в США 10,75 млрд. м3 (1985); в металлургии потребляется 55% производимого К., в хим. промсти - 20%. К. нетоксичен и негорюч, но поддерживает горение. В смеси с жидким К. взрывоопасны все углеводороды, в т.ч. масла, CS2. наиб. опасны малорастворимые горючие примеси, переходящие в жидком К. в твердое состояние (напр., ацетилен, пропилен, CS2). Предельно допустимое содержание в жидком К.: ацетилена 0,04 см3/л, CS2 0,04 см3/л, масла 0,4 мг/л. Газообразный К. хранят и транспортируют в стальных баллонах малой (0,4-12 л) и средней (20-50 л) емкости при давлении 15 и 20 МПа, а также в баллонах большой емкости (80-1000 л при 32 и 40 МПа), жидкий К. в сосудах Дьюара или в спец. цистернах. Для транспортировки жидкого и газообразного К. используют также спец. трубопроводы. Кислородные баллоны окрашены в голубой цвет и имеют надпись черными буквами "кислород". Впервые К. в чистом виде получил К. Шееле в 1771. Независимо от него К. был получен Дж. Пристли в 1774. В 1775 А. Лавуазье установил, что К.-составная часть воздуха, к-т и содержится во мн. в-вах. Лит.. Глизмаяенко Д.Л., Получение кислорода, 5 изд., М., 1972; Разумовский С. Д., Кислород-элементарные формы и свойства, М., 1979; Термодинамические свойства кислорода, М., 1981. Я. Д. Зельвенский.
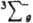 ) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему К. парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное
) два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях pх и pу, не спарены, благодаря чему К. парамагнитен (единств, парамагнитный газ, состоящий из гомоядерных двухатомных молекул); молярная магн. восприимчивость для газа 3,4400.10 (293 К), изменяется обратно пропорционально абс. т-ре (закон Кюри). Существуют два долгоживущих возбужденных состояния О2 - синглетное 1Dg (энергия возбуждения 94,1 кДж/моль, время жизни 45 мин) и синглетное 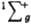 (энергия возбуждения 156,8 кДж/моль).
К.-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. К., в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного К. Известно более 1400 минералов, в состав к-рых входит К. Убыль К. в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением К. растениями при фотосинтезе. К. входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%.
Свойства. К.-бесцв. газ без запаха и вкуса. Т. кип. 90,188 К, т-ра тройной точки 54,361 К; плотн. при 273 К и нормальном давлении 1,42897 г/л, плотн. (в кг/м3) при 300 К: 6,43 (0,5 МПа), 12,91 (1 МПа), 52,51 (4 МПа); tкрит 154,581 К, ркрит 5.043 МПа, dкрит 436,2 кг/м3; С0p 29,4 Дж/(моль.К); DH0исп 6,8 кДж/моль (90,1 К); SO299 205,0 ДжДмоль.К); ур-ние температурной зависимости давления пара: в интервале 54-150 К lgp(гПа)=7,1648-377,153/T; теплопроводность 0,02465 Вт/(м.К) при 273 К; h 205,23 10-7 Па.с (298 К).
Жидкий К. окрашен в голубой цвет; плотн. 1,14 г/см3 (90,188 К); COp 54,40 Дж/(моль.К); теплопроводность 0,147 ВтДм.К) (90 К, 0,1 МПа); h 1,890.10-2 Па.с; g 13,2.10-5 Н/м (90 К), ур-ние температурной зависимости g=-38,46.10-3(1 - T/154,576)11/9 Н/м; nD 1,2149 (l=546,1 нм; 100 К); неэлектропроводен; молярная магн. восприимчивость 7,699.10-3 (90,1 К).
Твердый К. существует в неск. кристаллич. модификациях. Ниже 23,89 К устойчива а-форма с объемноцентрир. ром-бич, решеткой (при 21 К и 0,1 МПа а = 0,55 нм, b= 0,382 нм, с=0,344 нм, плотн. 1,46 г/см3), при 23,89-43,8 К-b-форма с гексаген, кристаллич. решеткой (при 28 К и 0,1 МПа а = 0,3307 нм, с = 1,1254 нм), выше 43,8 К существует g-форма с кубич. решеткой (а = 0,683 нм); DH° полиморфных переходов g:b 744 Дж/моль (43,818 К), b:a 93,8 Дж/моль (23,878 К); тройная точка b-g-газообразный К.: т-ра 283 К, давление 5,0 ГПа; DHOпл 443 Дж/молъ; ур-ние температурной зависимости плотности d=1,5154-0,004220T г/см3 (44 54 К), a-, b- и g- О2 кристаллы светло-синего цвета. Модификация р антиферромагнитна, a и g парамагнитны, их магн. восприимчивость соотв. 1,760.10-3 (23,7 К) и 1,0200.10-5 (54,3 К). При 298 К и повышении давления до 5,9 ГПа К. кристаллизуется, образуя окрашенную в розовый цвет гексаген. b-форму (а = 0,2849 нм, с = 1,0232 нм), а при повышении давления до 9 ГПа оранжевую ромбич. e-форму (при 9,6 ГПа а=0,42151 нм, b=0,29567 нм, с=0,66897 нм, плотн. 2,548 г/см3).
Р-римость К. при атм. давлении и 293 К (в см3/см3): в воде 0,031, этаноле 0,2201, метаноле 0,2557, ацетоне 0,2313; р-римость в воде при 373 К 0,017 см3/см3; р-римость при 274 К (в % по объему): в перфторбутилтетрагидрофуране 48,5, перфтордекалине 45,0, перфтор-l-метилдекалине 42,3. Хорошие твердые поглотители К. платиновая чернь и активный древесный уголь. Благородные металлы в расплавл. состоянии поглощают значит. кол-ва К., напр. при 960 °С один объем серебра поглощает ~22 объема К., к-рый при
охлаждении почти полностью выделяется. Способностью поглощать К. обладают мн. твердые металлы и оксиды, при этом образуются нестехиометрич. соединения.
К. отличается высокой хим. активностью, образуя соед. со всеми элементами, кроме Не, Ne и Аr. Атом К. в хим. соед. обычно приобретает электроны и имеет отрицат. эффективный заряд. Соед., в к-рых электроны оттягиваются от атома К., крайне редки (напр., OF2). С простыми в-вами, кроме Au, Pt, Xe и Кr, К. реагирует непосредственно при обычных условиях или при нагр., а также в присут. катализаторов. Р-ции с галогенами проходят под действием электрич. разряда или УФ излучения. В р-циях со всеми простыми в-вами, кроме F2, К. является окислителем.
Мол. К. образует три разл. ионные формы, каждая из к-рых дает начало классу соед.: О-2 - супероксидам, О22- - пeроксидам (см. Пероксидные соединения неорганические, Пе-роксидные соединения органические), О+2 - диоксигенильным соeдинениям. Озон образует озониды, в к-рых ионная форма К.-О-3. Молекула О2 присоединяется как слабый лиганд к нек-рым комплексам Fe, Co, Мn, Сu. Среди таких соед. важное значение имеет гемоглобин, к-рый осуществляет перенос К. в организме теплокровных.
Р-ции с К., сопровождающиеся интенсивным выделением энeргии, наз. горением. Большую роль играют взаимод. К. с металлами в присут. влаги-атм. коррозия металлов, а также дыхание живых организмов и гниение. В результате гниения сложные орг. в-ва погибших животных и растений превращаются в более простые и в конечном счете в СО2 и волу.
С водородом К. реагирует с образованием воды и выделением большого кол-ва тепла (286 кДж на моль Н2). При комнатной т-ре р-ция идет крайне медленно, в присут. катализаторов - сравнительно быстро уже при 80-100 °С (эту р-цию используют для очистки Н2 и инертных газов от примеси О2). Выше 550 °С р-ция Н2 с О2 сопровождается взрывом.
Из элементов I гр. наиб. легко реагируют с К. Rb и Cs, к-рые самовоспламеняются на воздухе, К, Na и Li реагируют с К. медленнее, р-ция ускоряется в присут. паров воды. При сжигании щелочных металлов (кроме Li) в атмосфере К. образуются пероксиды М2О2 и супероксиды МО2. С элементами подгруппы IIа К. реагирует сравнительно легко, напр., Ва способен воспламеняться на воздухе при 20-25°С, Mg и Be воспламеняются выше 500 °С; продукты р-ции в этих случаях - оксиды и пероксиды. С элементами подгруппы IIб К. взаимод. с большим трудом, р-ция К. с Zn, Cd и Hg происходит только при более высоких т-рах (известны породы, в к-рых Hg содержится в элементарной форме). На пов-стях Zn и Cd образуются прочные пленки их оксидов, предохраняющие металлы от дальнейшего окисления.
Элементы III гр. реагируют с К. только при нагр., образуя оксиды. Компактные металлы Ti, Zr, Hf устойчивы к действию К. С углеродом К. реагирует с образованием СО2 и выделением тепла (394 кДж/моль); с аморфным углеродом р-ция протекает при небольшом нагревании, с алмазом и графитом - выше 700 °С.
С азотом К. реагирует лишь выше 1200°С с образованием NO, к-рый далее легко окисляется К. до NO2 уже при комнатной т-ре. Белый фосфор склонен к самовозгоранию на воздухе при комнатной т-ре.
Элементы VI гр. S, Se и Те реагируют с К. с заметной скоростью при умеренном нагревании. Заметное окисление W и Мо наблюдается выше 400 °С, Cr - при значительно более высокой т-ре.
К. энергично окисляет орг. соединения. Горение жидких топлив и горючего газа происходит в результате р-ции К. с углеводородами.
(энергия возбуждения 156,8 кДж/моль).
К.-наиб. распространенный элемент на Земле. В атмосфере содержится 23,10% по массе (20,95% по объему) своб. К., в гидросфере и литосфере - соотв. 85,82 и 47% по массе связанного К. Известно более 1400 минералов, в состав к-рых входит К. Убыль К. в атмосфере в результате окисления, в т. ч. горения, гниения и дыхания, возмещается выделением К. растениями при фотосинтезе. К. входит в состав всех в-в, из к-рых построены живые организмы; в организме человека его содержится ок. 65%.
Свойства. К.-бесцв. газ без запаха и вкуса. Т. кип. 90,188 К, т-ра тройной точки 54,361 К; плотн. при 273 К и нормальном давлении 1,42897 г/л, плотн. (в кг/м3) при 300 К: 6,43 (0,5 МПа), 12,91 (1 МПа), 52,51 (4 МПа); tкрит 154,581 К, ркрит 5.043 МПа, dкрит 436,2 кг/м3; С0p 29,4 Дж/(моль.К); DH0исп 6,8 кДж/моль (90,1 К); SO299 205,0 ДжДмоль.К); ур-ние температурной зависимости давления пара: в интервале 54-150 К lgp(гПа)=7,1648-377,153/T; теплопроводность 0,02465 Вт/(м.К) при 273 К; h 205,23 10-7 Па.с (298 К).
Жидкий К. окрашен в голубой цвет; плотн. 1,14 г/см3 (90,188 К); COp 54,40 Дж/(моль.К); теплопроводность 0,147 ВтДм.К) (90 К, 0,1 МПа); h 1,890.10-2 Па.с; g 13,2.10-5 Н/м (90 К), ур-ние температурной зависимости g=-38,46.10-3(1 - T/154,576)11/9 Н/м; nD 1,2149 (l=546,1 нм; 100 К); неэлектропроводен; молярная магн. восприимчивость 7,699.10-3 (90,1 К).
Твердый К. существует в неск. кристаллич. модификациях. Ниже 23,89 К устойчива а-форма с объемноцентрир. ром-бич, решеткой (при 21 К и 0,1 МПа а = 0,55 нм, b= 0,382 нм, с=0,344 нм, плотн. 1,46 г/см3), при 23,89-43,8 К-b-форма с гексаген, кристаллич. решеткой (при 28 К и 0,1 МПа а = 0,3307 нм, с = 1,1254 нм), выше 43,8 К существует g-форма с кубич. решеткой (а = 0,683 нм); DH° полиморфных переходов g:b 744 Дж/моль (43,818 К), b:a 93,8 Дж/моль (23,878 К); тройная точка b-g-газообразный К.: т-ра 283 К, давление 5,0 ГПа; DHOпл 443 Дж/молъ; ур-ние температурной зависимости плотности d=1,5154-0,004220T г/см3 (44 54 К), a-, b- и g- О2 кристаллы светло-синего цвета. Модификация р антиферромагнитна, a и g парамагнитны, их магн. восприимчивость соотв. 1,760.10-3 (23,7 К) и 1,0200.10-5 (54,3 К). При 298 К и повышении давления до 5,9 ГПа К. кристаллизуется, образуя окрашенную в розовый цвет гексаген. b-форму (а = 0,2849 нм, с = 1,0232 нм), а при повышении давления до 9 ГПа оранжевую ромбич. e-форму (при 9,6 ГПа а=0,42151 нм, b=0,29567 нм, с=0,66897 нм, плотн. 2,548 г/см3).
Р-римость К. при атм. давлении и 293 К (в см3/см3): в воде 0,031, этаноле 0,2201, метаноле 0,2557, ацетоне 0,2313; р-римость в воде при 373 К 0,017 см3/см3; р-римость при 274 К (в % по объему): в перфторбутилтетрагидрофуране 48,5, перфтордекалине 45,0, перфтор-l-метилдекалине 42,3. Хорошие твердые поглотители К. платиновая чернь и активный древесный уголь. Благородные металлы в расплавл. состоянии поглощают значит. кол-ва К., напр. при 960 °С один объем серебра поглощает ~22 объема К., к-рый при
охлаждении почти полностью выделяется. Способностью поглощать К. обладают мн. твердые металлы и оксиды, при этом образуются нестехиометрич. соединения.
К. отличается высокой хим. активностью, образуя соед. со всеми элементами, кроме Не, Ne и Аr. Атом К. в хим. соед. обычно приобретает электроны и имеет отрицат. эффективный заряд. Соед., в к-рых электроны оттягиваются от атома К., крайне редки (напр., OF2). С простыми в-вами, кроме Au, Pt, Xe и Кr, К. реагирует непосредственно при обычных условиях или при нагр., а также в присут. катализаторов. Р-ции с галогенами проходят под действием электрич. разряда или УФ излучения. В р-циях со всеми простыми в-вами, кроме F2, К. является окислителем.
Мол. К. образует три разл. ионные формы, каждая из к-рых дает начало классу соед.: О-2 - супероксидам, О22- - пeроксидам (см. Пероксидные соединения неорганические, Пе-роксидные соединения органические), О+2 - диоксигенильным соeдинениям. Озон образует озониды, в к-рых ионная форма К.-О-3. Молекула О2 присоединяется как слабый лиганд к нек-рым комплексам Fe, Co, Мn, Сu. Среди таких соед. важное значение имеет гемоглобин, к-рый осуществляет перенос К. в организме теплокровных.
Р-ции с К., сопровождающиеся интенсивным выделением энeргии, наз. горением. Большую роль играют взаимод. К. с металлами в присут. влаги-атм. коррозия металлов, а также дыхание живых организмов и гниение. В результате гниения сложные орг. в-ва погибших животных и растений превращаются в более простые и в конечном счете в СО2 и волу.
С водородом К. реагирует с образованием воды и выделением большого кол-ва тепла (286 кДж на моль Н2). При комнатной т-ре р-ция идет крайне медленно, в присут. катализаторов - сравнительно быстро уже при 80-100 °С (эту р-цию используют для очистки Н2 и инертных газов от примеси О2). Выше 550 °С р-ция Н2 с О2 сопровождается взрывом.
Из элементов I гр. наиб. легко реагируют с К. Rb и Cs, к-рые самовоспламеняются на воздухе, К, Na и Li реагируют с К. медленнее, р-ция ускоряется в присут. паров воды. При сжигании щелочных металлов (кроме Li) в атмосфере К. образуются пероксиды М2О2 и супероксиды МО2. С элементами подгруппы IIа К. реагирует сравнительно легко, напр., Ва способен воспламеняться на воздухе при 20-25°С, Mg и Be воспламеняются выше 500 °С; продукты р-ции в этих случаях - оксиды и пероксиды. С элементами подгруппы IIб К. взаимод. с большим трудом, р-ция К. с Zn, Cd и Hg происходит только при более высоких т-рах (известны породы, в к-рых Hg содержится в элементарной форме). На пов-стях Zn и Cd образуются прочные пленки их оксидов, предохраняющие металлы от дальнейшего окисления.
Элементы III гр. реагируют с К. только при нагр., образуя оксиды. Компактные металлы Ti, Zr, Hf устойчивы к действию К. С углеродом К. реагирует с образованием СО2 и выделением тепла (394 кДж/моль); с аморфным углеродом р-ция протекает при небольшом нагревании, с алмазом и графитом - выше 700 °С.
С азотом К. реагирует лишь выше 1200°С с образованием NO, к-рый далее легко окисляется К. до NO2 уже при комнатной т-ре. Белый фосфор склонен к самовозгоранию на воздухе при комнатной т-ре.
Элементы VI гр. S, Se и Те реагируют с К. с заметной скоростью при умеренном нагревании. Заметное окисление W и Мо наблюдается выше 400 °С, Cr - при значительно более высокой т-ре.
К. энергично окисляет орг. соединения. Горение жидких топлив и горючего газа происходит в результате р-ции К. с углеводородами.
Получение. В пром-сти К. получают воздуха разделением, гл. обр. методом низкотемпературной ректификации. Его производят также наряду с Н2 при пром. электролизе воды. Выпускают газообразный технол. К. (92-98% О2), техн. (1-й сорт 99,7% О2, 2-й сорт 99,5% и 3-й сорт 99,2%) и жидкий (не менее 99,7% О2). Производится также К. для лечебных целей ("медицинский кислород", содержащий 99,5% O2). Для дыхания в замкнутых помещениях (подводные лодки, космич. аппараты и др.) используют твердые источники К., действие к-рых основано на самораспространяющейся экзо-термич. р-ции между носителем К. (хлоратом или перхлоратом) и горючим. Напр., смесь NaClO3 (80%), порошка Fe (10%), ВаО2 (4%) и стекловолокна (6%) прессуют в виде цилиндров; после поджигания такая кислородная свеча горит со скоростью 0,15-0,2 мм/с, выделяя чистый, пригодный для дыхания К. в кол-ве 240 л/кг (см. Пиротехнические источники газов). В лаборатории К. получают разложением при нагр. оксидов (напр., HgO) или кислородсодержащих солей (напр., КСlO3, КМnО4), а также электролизом водного р-ра NaOH. Однако чаще всего используют пром. К., поставляемый в баллонах под давлением.
Определение. Концентрацию К. в газах определяют с помощью ручных газоанализаторов, напр. волюмометрич. методом по изменению известного объема анализируемой пробы после поглощения из нее О2 р-рами - медноаммиачным, пирогаллола, NaHSO3 и др. Для непрерывного определения К. в газах применяются автоматич. термомагн. газоанализаторы, основанные на высокой магн. восприимчивости К. Для определения малых концентраций К. в инертных газах или водороде (менее 1%) используют автоматич. термохим., электрохим., гальванич. и др. газоанализаторы. С этой же целью применяют колориметрич. метод (с использованием прибора Мугдана), основанный на окислении бесцв. аммиачного комплекса Cu(I) в яркоокра-шенное соед. Cu(II). К., растворенный в воде, определяют также колориметрически, напр. по образованию красного окрашивания при окислении восстановленного индигокар-мина. В орг. соед. К. определяют в виде СО или СО2 после высокотемпературного пиролиза анализируемого в-ва в потоке инертного газа. Для определения концентрации К. в стали и сплавах используют электрохим. датчики с твердым электролитом (стабилизированный ZrO2). См. также Газовый анализ, Газоанализаторы.
Применение. К. используют как окислитель: в металлургии - при выплавке чугуна и стали (в доменном, кислородно-конвертерном и мартеновском произ-вах), в процессах шахтной, взвешенной и конвертерной плавки цветных металлов; в прокатном произ-ве; при огневой зачистке металлов; в литейном произ-ве; при термитной сварке и резке металлов; в хим. и нефтехим. пром-сти-при произ-ве HNO3, H2SO4, метанола, ацетилена; формальдегида, оксидов, пероксидов и др. в-в. К. используют в лечебных целях в медицине, а также в кислородно-дыхат. аппаратах (в космич. кораблях, на подводных судах, при высотных полетах, подводных и спасательных работах). Жидкий К.-окислитель для ракетных топлив; его используют также при взрывных работах, как хладагент в лаб. практике. Произ-во К. в США 10,75 млрд. м3 (1985); в металлургии потребляется 55% производимого К., в хим. промсти - 20%. К. нетоксичен и негорюч, но поддерживает горение. В смеси с жидким К. взрывоопасны все углеводороды, в т.ч. масла, CS2. наиб. опасны малорастворимые горючие примеси, переходящие в жидком К. в твердое состояние (напр., ацетилен, пропилен, CS2). Предельно допустимое содержание в жидком К.: ацетилена 0,04 см3/л, CS2 0,04 см3/л, масла 0,4 мг/л. Газообразный К. хранят и транспортируют в стальных баллонах малой (0,4-12 л) и средней (20-50 л) емкости при давлении 15 и 20 МПа, а также в баллонах большой емкости (80-1000 л при 32 и 40 МПа), жидкий К. в сосудах Дьюара или в спец. цистернах. Для транспортировки жидкого и газообразного К. используют также спец. трубопроводы. Кислородные баллоны окрашены в голубой цвет и имеют надпись черными буквами "кислород". Впервые К. в чистом виде получил К. Шееле в 1771. Независимо от него К. был получен Дж. Пристли в 1774. В 1775 А. Лавуазье установил, что К.-составная часть воздуха, к-т и содержится во мн. в-вах. Лит.. Глизмаяенко Д.Л., Получение кислорода, 5 изд., М., 1972; Разумовский С. Д., Кислород-элементарные формы и свойства, М., 1979; Термодинамические свойства кислорода, М., 1981. Я. Д. Зельвенский.
-капролактам
Keтoальдегиды
Кабачника-филдса реакция
Кавитация
Кадио-ходкевича реакция
Кадионы
Кадмий
Кадмийорганические соединения
Кадмия антимонид
Кадмия галогениды
Кадмия нитрат
Кадмия оксид
Кадмия селенид
Кадмия сульфат
Кадмия сульфид
Кадмия теллурид
Кадмия хлорид
Казеин
Каландрование полимеров
Калий
Калийная селитра
Калийные удобрения
Калифорний
Калия гексацианоферраты
Калия гидрокарбонат
Калия гидроксид
Калия дихромат
Калия дицианоаурат(i)
Калия иодид
Калия карбонат
Калия нитрат
Калия оксид
Калия перманганат
Калия пероксодикарбонат
Калия пероксосульфаты
Калия сульфат
Калия сульфиды
Калия фосфаты
Калия фторид
Калия хлорид
Калия цианат
Калия цианид
Калия этилксантогенат
Каломель
Каломельный электрод
Калориметрия
Кальмодулин
Кальциевая селитра
Кальций
Кальцийорганические соединения
Кальцитонин
Кальциферолы
Кальция алюминаты
Кальция бораты
Кальция вольфраматы
Кальция галогениды
Кальция гидроксид
Кальция гипохлорит
Кальция карбид
Кальция карбонат
Кальция нитрат
Кальция оксид
Кальция силикаты
Кальция сульфат
Кальция фосфаты
Кальция фторид
Кальция хлорид
Кальция цианамид
Каменноугольная смола
Каменноугольные масла
Каменные угли
Камфан
Камфен
Камфеновые перегруппировки
Камфора
Канатные смазки
Канифоль
Канниццаро реакция
Канцерогенные вещества
Каолин
Капельный анализ
Капиллярная конденсация
Капиллярная хроматография
Капиллярные явления
Капиллярный осмос
Каплеулавливание
Каприловая кислота
Капрон
Капроновая кислота
Капсаицин
Капсулирование
Каптакс
Карбазол
Карбамид
Карбамидные смолы
Карбаминовая кислота
Карбанионы
Карбеновые комплексы переходных металлов
Карбены
Карбиды
Карбиламины
Карбин
Карбиновые комплексы переходных металлов
Карбитолы
Карбкатионы
Карбодиимиды
Карбодифосфораны
Карбоксилатные каучуки
Карбоксилирование
Карбоксиметилцеллюлоза
Карбоксипептидазы
Карбоксиэстеразы
Карболины
Карбонаты неорганические
Карбонаты органические
Карбонаты природные
Карбонизация
Карбонилирование
Карбонилфторид
Карбонилы металлов
Карбонильные соединения
Карбония ионы
Карбоновые кислоты
Карбопласты
Карборансодержащие полимеры
Карбораны
Карборунд
Карбоциклические соединения
Карвон
Кардовые полимеры
Карены
Кариофиллен
Кариуса метод
Каркасные соединения
Карнаубский воск
Карнитин
Карнозин
Каротиноиды
Каррагинаны
Касторовое масло
Катаболизм
Катализ
Катализаторы
Катализаторы гидрирования
Катализаторы дегидрирования
Катализаторы окисления
Катализаторы полимеризации
Каталитический крекинг
Каталитический реформинг
Каталитических реакций кинетика
Катапины
Катенаны
Катепсины
Катехоламины
Катион-радикалы
Катиониты
Катионная полимеризация
Катионные красители
Катионообменные смолы
Катионотропные перегруппировки
Катионы
Катодная защита
Катодолюминесцентный микроанализ
Каустобиолиты
Каучук натуральный
Каучуки синтетические
Качественный анализ
Квадрупольный момент
Квазикристалл
Квазирацематы
Квазистационарности приближение
Квантовая механика
Квантовая химия
Квантовое состояние
Квантовые переходы
Квантовый выход
Кварц
Кварцевое стекло
Квасцы
Кверцетин
Кедровое масло
Керамика
Кератины
Кермель
Керметы
Керосин
Керра эффект
Кетали
Кетены
Кетимины
Кетокарбoновые кислoты
Кетокислоты
Кетон малины
Кетоны
Кибернетика
Кижнера реакция
Кижнера-вольфа реакция
Килиани-фишера реакция
Кинe-замещeние
Кинетика химическая
Кинетическая кривая
Кинетическая теория газов
Кинетические методы анализа
Кинетический изотопный эффект
Кинетическое уравнение
Кинины
Киноплёнки
Кипение
Кипреналь
Кипящий слой
Кирсанова реакция
Кирхгофа уравнение
Кислoтно-оснoвное титрование
Кислoтно-основнoй катализ
Кислород
Кислорода фториды
Кислородный индекс
Кислотное число
Кислотные красители
Кислотоупoрные прирoдные материалы
Кислоты и основания
Кислоты неорганические
Клeя-киннера-пeррена реакция
Клайзена конденсация
Клайзена перегруппировка
Клайзена-шмидта реакция
Клапейрона-клаузиуса уравнение
Клапейрона-менделеева уравнение
Кларки химических элементов
Классификация
Классификация гидравлическая
Кластеры
Клатраты
Клеевые краски
Клеи природные
Клеи синтетические
Клей
Клей неорганические
Клемменсена реакция
Клетки эффект
Клешневидные соединения
Клофелин
Клофибрат
Кнорра реакция
Кнёвенагеля реакция
Коагулянты
Коагуляция
Коалесценция
Коацервация
Кобальта ацетат
Кобальта галогениды
Кобальта гидроксиды
Кобальта карбонаты
Кобальта карбонилы
Кобальта нитраты
Кобальта оксиды
Кобальта сплавы
Кобальта сульфаты
Кобальта хлориды
Кобальтовые удобрения
Кобальторганические соединения
Кобамидные коферменты
Ковалентная связь
Ковалентные кристаллы
Ковалентные радиусы
Ковар
Когезия
Кодеин
Кодон
Кожа
Кожа искусственная
Койевая кислота
Кокаин
Кокосовое масло
Кокс каменноугольный
Кокс нефтяной
Кокс пековый
Коксование
Коксовое число
Коксохимия
Коксуемость углей
Колебательные реакции
Колебательные спектры
Количественный анализ
Коллoидные раствoры
Коллаген
Коллидины
Коллоидная химия
Коллоидные системы
Коллоксилин
Колориметрический анализ
Колхициновые алкалоиды
Кольбе реакции
Кольбе шмитта реакция
Кольрауша закон
Комбинационного рассеяния спектроскопия
Компаунды полимерные
Компенсационный эффект
Комплексные соединения
Комплексометрия
Комплексонометрия
Комплексоны
Комплексообразующие ионообменные смолы
Комплемент
Комплементарность
Композиты
Композиционные материалы
Компонент системы
Компрессорные масла
Компрессорные машины
Компьютерный синтез
Конго красный
Кондакова реакция
Конденсации реакции
Конденсация
Конденсация фракционная
Кондуктометрия
Конкурирующих реакций метод
Коновалова законы
Коновалова реакция
Конопляное масло
Консервационные масла
Консервационные смазки
Консистентные смазки
Константа равновесия
Константа скорости
Константан
Конструкционная керамика
Контакт петрова
Контактная очистка
Конфигурационного взаимодействия метод
Конфигурация стереохимическая
Конформации молекулы
Конформационные эффекты
Конформационный анализ
Концентрация
Концентрирование
Координата реакции
Координациoнно-иoнная полимеризация
Координационная связь
Координационное число
Координационные полимеры
Координационные полиэдры
Координационные соединения
Копалы
Кордиты
Коричный альдегид
Коричный спирт
Кормовые фосфаты
Корреляционные соотношения
Корреляция конфигураций
Корриноиды
Коррозионная усталость
Коррозионностойкие материалы
Коррозионные испытания
Коррозия металлов
Коррозия под напряжением
Кортикоиды
Коршун климовой метод
Космические смазки
Космохимия
Котельные топлива
Коттона эффект
Кофеин
Кофермент
Коферменты
Коха-хаафа реакция
Коэрцитивная сила
Крапплак
Красители природные
Красители синтетические
Краски
Красуского правило
Кратные связи
Краун-эфиры
Крахмал
Крашение бумаги
Крашение волокон
Крашение древесины
Крашение кожи
Крашение меха
Крашение оксидированного алюминия
Крашение пластических масс
Крашение резино-технических изделий
Креатинфосфорная кислота
Кребса цикл
Крезолы
Крекинг
Кремнефтористоводородная кислота
Кремниевые кислоты
Кремний
Кремнийорганические жидкости
Кремнийорганические каучуки
Кремнийорганические лаки
Кремнийорганические полимеры
Кремнийорганические соединения
Кремнийэлементоорганические соединения
Кремния диоксид
Кремния иодиды
Кремния карбид
Кремния нитрид
Кремния оксид
Кремния фториды
Кремния хлориды
Криоскопия
Криохимия
Криптанды
Криптон
Криптона дифторид
Кристаллизационные методы разделения смесей
Кристаллизация
Кристаллическая структура
Кристаллический фиолетовый
Кристаллического поля теория
Кристаллическое состояние
Кристаллическое состояние полимеров
Кристаллогидраты
Кристаллосольваты
Кристаллофосфоры
Кристаллохимия
Кристаллы
Критические явления
Критическое состояние
Кровезаменители
Кроны
Кротоновая кислота
Кротоновая конденсация
Кротоновый альдегид
Круговой дихроизм
Крёнке реакция
Ксаитемовые красители
Ксантин
Ксантинола никотинат
Ксантогенаты
Ксантопротеиновая реакция
Ксантотоксин
Ксенон
Ксенона фториды
Ксиленоловый оранжевый
Ксилидины
Ксилилендиамины
Ксилит
Ксилолы
Кубовые красители
Кубогены
Кубозоли
Кукурузное масло
Кулонометрия
Кумарин
Кумароно-инденовые смолы
Кумилгидропероксид
Кумилпероксид
Кумол
Кумулены
Кунжутное масло
Купманса теорема
Купферон
Курареподобные средства
Курарин
Курнакова соединения
Курциуса реакция
Курчатовий
Кучерова реакция
Кьельдаля метод
Кэмпса реакция
Кэрролла-каймела реакция
Кюри точка
Кюрий
Кёнигса-кнорра реакция

