Словарь научных терминов
Кремний
КРЕМНИЙ (Silicium) Si, химический элемент IV гр. периодич. системы, ат. н. 14, ат. м. 28,0855. Состоит из трех стабильных изотопов 28Si (92,27%), 29Si (4,68%) и 30Si (3,05%). Поперечное сечение захвата тепловых нейтронов 1,3.10-29 м2. Конфигурация внеш. электронной оболочки 3s23p2; степень окисления +4 (наиб. устойчива), +3, +2 и +1; энергии ионизации при последоват. переходе от Si° к Si4+ соотв. 8,1517, 16,342, 33,46 и 45,13 эВ; сродство к электрону 1,22 эВ; электроотрицательность по Полингу 1,8; атомный радиус 0,133, ионный радиус Si4+ (в скобках указаны координац. числа) 0,040 нм (4), 0,054 нм (6), ковалентный - 0,1175 нм.
К.-второй после кислорода по распространенности в земной коре элемент (27,6% по массе). В своб. состоянии в природе не встречается, находится преим. в виде SiO2 (см. Кремния диоксид) или силикатов. В виде SiO2 К. входят в состав растит. и животных организмов (напр., скелетные части).
Свойства. Компактный К.- в-во серебристо-серого цвета с металлич. блеском. Кристаллич. решетка устойчивой модификации кубич. гранецентрированная типа алмаза, а=0,54307 нм, пространств. группа Fd3m, z=4. При высоких давлениях существуют др. полиморфные модификации: при 20 ГПа-К. I с тетрагон. решеткой (а=0,4686 нм, с=0,2585 нм), выше 20 ГПа-К. II с кубич. (а=0,644 нм) и К. III с гексагон. (а=0,380 нм, с=0,628 нм). При кристаллизации из газовой фазы на пов-стях с т-рой ниже 600 °С образуется аморфный К. Для кристаллич. Si т. пл. 1415 °С (плавится с уменьшением объема на 9%), т. кип. 3249 °С; плотн. 2,33 г/см3; C0p 20,16 Дж/(моль.К); DH0пл 49,9 кДж/моль, DH0исп 445,2 кДж/моль; S298 18,9 Дж/(моль.К); давление пара 0,046 Па (1415 °С); температурный коэф. линейного расширения 3,72.10-6К-1 (291-1273 К) и -.0,6.10-6 К-1 (84 К); теплопроводность 95,5 Вт/(м.К); р 2,4-107 Ом м (25 °С); т-ра Дебая 645 К; e 12; диамагнетик, магн. восприимчивость — 3,9.10-6. При обычных условиях К. хрупок, выше 800 °С становится пластичным. К. прозрачен для И К излучения при длинах волн l>1 мкм; коэф. преломления 3,565 (l=1,05 мкм), 3,443 (l=2,6 мкм), 3,45 (l= 2-10 мкм); отражат. способность 0,3 (l>1,5 мкм). К. - полупроводник; ширина запрещенной зоны 1,21 эВ при т-ре ок. 0 К и 1,09 эВ при 300 К; концентрация носителей тока в К. с собственной проводимостью 1,5-1016 м-3 (300 К); температурная зависимость подвижности электронов и дырок [м2/(В.с)] определяется соотв. выражениями: mn=4,0.105Т-2,6 (300[T[400 К) и mр = 2,5.104T-2,3 (150[T[400 К); при 300 К mn= 0,145 м2/(В.с), mp=0,048 м2/(В.с), коэф. диффузии электронов 3,5.10-3 м2/с, дырок - 1,3.10-3 м2/с. Электрофиз. св-ва К. зависят от природы и концентрации присутствующих примесей и структурных дефектов. Для получения монокристаллов К. с дырочной проводимостью используют легирующие добавки В, Al, Ga, In (акцепторные примеси), с электронной проводимостью - Р, As, Sb (донорные примеси). Примеси Аu, Сu, Fe, Mn, V и нек-рые др. существенно снижают время жизни носителей тока в монокристаллах К. Макс, р-римость примесей в К. наблюдается при 1200-1300 °С и м. б. грубо оценена по значению коэф. распределения между твердым К. и его расплавом. Акцепторные примеси в К. имеют большие значения коэф. диффузии, чем донорные. Ряд примесей (Li, Сu, Аu) диффундирует по междоузлиям кристаллич. решетки с очень высокими скоростями. Для определения содержания примесей в К. высокой чистоты используют прецизионные методы: спектральный и активационный анализ, метод ЭПР и др. Производят монокристаллы К. без дислокаций диаметром до 0,156 м. Осн. дефекты в таких монокристаллах К.-скопления собств. междоузельных атомов, вакансий и атомов остаточных примесей. Для определения природы и содержания структурных дефектов в К. применяют избират. травление (в осн. смесью к-т: HF, HNO3 и СН3СООН), рентгеновский и др. методы. Электрич. св-ва К. могут сильно изменяться при термич. обработке. Так, нагревание монокристаллов, содержащих кислород, до 400-500 °С приводит к увеличению электронной проводимости, а при послед. нагревании до 1 1000-1200 °С этот эффект пропадает. Обычно термич. обработка приводит к существ. снижению времени жизни носителей тока. Для предотвращения вредного действия термич. обработки используют предварит. обработку пов-сти монокристаллов К. спец. орг. реактивами, отжиг в хлорсодержащей атмосфере, грубую шлифовку, бомбардировку ионами и др. методы. При низких т-рах К. химически инертен, при нагр. его реакц. способность резко возрастает. Особенно активен расплавленный К. Координац. число атома К. 4, иногда 6 (напр., во фторосиликатах, содержащих анион [SiF6]2-). Соед., где К. формально двухвалентен, по-видимому, содержат связь Si—Si и, как правило, полимерны. Благодаря образующейся на пов-сти защитной оксидной пленке К. устойчив на воздухе даже при повыш. т-рах. Окисляется О2 выше 400°С до SiO2 (см. также Кремния оксид). Стоек к действию к-т, взаимод. только со смесью HNO3 и фтористоводородной к-ты. Хорошо реагирует с р-рами щелочей с выделением Н2 и образованием силикатов. Взаимод. с F2 уже при комнатной т-ре, с остальными галогенами - при 300-500 °С с образованием галогенидов SiX4 или Sin,X2n+2 (см. Кремния иодиды, Кремния фториды, Кремния хлориды). С парами S при 600 °С дает дисульфид SiS2, к-рый выше 600 °С переходит в моносульфид SiS; аналогичные, хотя и менее прочные соед., образует с Те и Se. С Н2 К. непосредственно не реагирует, поэтому силаны SinH2n+2 получают косвенным путем - разложением силицидов. Аморфный К. обладает способностью растворять значит. кол-ва разл. газов, прежде всего Н2. При этом образуется твердый р-р (до 47 ат. % водорода), называемый l-Si:H, к-рый обладает полупроводниковыми св-вами. С азотом выше 1000 °С К. образует кремния нитрид Si3N4, с фосфором - фосфид SiP, с мышьяком - арсениды SiAs2 и SiAs, с углеродом -кремния карбид SiC, с бором - термически и химически стойкие бориды SiB3, SiB6 и SiB12. С большинством металлов дает тугоплавкие высокотвердые силициды. Об орг. производных К. см. Кремнийорганические полимеры, Кремнийорганические соединения, Кремнийэлементоорганические соединения.
Получение. К. производят восстановлением расплава SiO2 углеродом в дуговых печах при 1800°С. Чистота техн. продукта после спец. кислотной обработки ок. 99,9%. Очень небольшие кол-ва К. получают электролизом р-ров Na2SiF6 или K2SiF6 в расплавах. Для получения К. высокой чистоты техн. продукт хлорируют до SiQ4 или SiHCl3. Эти хлориды подвергают глубокой очистке ректификацией, сорбцией, путем частичного гидролиза и спец. термич. обработок, а затем восстанавливают при 1200-1300 °С высокочистым Н2 в установках из нержавеющей стали или непрозрачного кварцевого стекла. Восстанавливаемый К. осаждают на прутки из К. высокой чистоты. Др. пром. метод получения К. высокой чистоты основан на разложении ок. 1000 °С SiH4, предварительно очищенного ректификацией. SiH4 синтезируют взаимод. Mg2Si с соляной или уксусной к-той, диспропор-ционированием SiH(OC2H5)3 в присут. Na или р-цией LiAlH4 с SiQ4 в эфире. Перечисл. методами получают К. с суммарным содержанием остаточных примесей 10-7-10-8 % по массе. Монокристаллы К. выращивают по методу Чохральского или бестигельной зонной плавкой (см. Монокристаллов выращивание). В первом случае процесс проводят в кварцевых тиглях в вакууме или инертной атмосфере с применением нагревателей из особо чистого графита. Масса исходной загрузки 60-100 кг, диаметр получаемых монокристаллов до 0,15 м, длина до 1,5-2,0 м. Зонную плавку проводят в глубоком вакууме или атмосфере особо чистого Н2; этим способом получают наиб. чистые монокристаллы. Диаметр монокристаллов до 0,125 м, длина до 1,5 м. Легируют монокристаллы непосредственно в процессе выращивания. Для получения однородных монокристаллов, легированных фосфором, их часто облучают медленными нейтронами [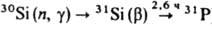 ].
Профилир. монокристаллы выращивают с помощью спец. формообразователя по способу Степанова, "горизонтальным сдергиванием" со своб. пов-сти расплава, кристаллизацией на спец. дендритных затравках. Поликристаллич. слитки получают направленной кристаллизацией в графитовой изложнице в условиях строго контролируемого тепло-отвода.
Осн. пром. метод получения эпитаксиальных слоев и структур К.-хим. осаждение из газовой фазы с использованием смеси особо чистых SiCl4 и Н2. Процесс проводят в проточных металлич. и кварцевых реакторах при 1250 °С и. атм. давлении с применением индукционного или радиационного нагрева. Эпитаксиальные слои наращивают на ориентированные и прошедшие спец. мех. и хим. обработку подложки из монокристаллич. К., размещаемые на кварцевом или графитовом (с покрытием SiC) пьедестале. Для снижения т-ры эпитаксиального наращивания в качестве источника К. используют SiH2Cl2, а сам процесс проводят при 6,6-9,3 кПа. Применяют также термич. разложение SiH4 (т-ра кристаллизации до 1000-1050 °C). Самую низкую т-ру кристаллизации (700-800 °С) обеспечивает метод мол. эпитаксии - наращивание из мол. пучков, получаемых нагреванием кремниевых заготовок электронным лучом в условиях глубокого вакуума (10-9-10-10 Па). Жидкофазную эпитаксию из р-ра К. в металлич. расплаве (наиб. часто Sn) проводят при 1100-1200°С.
Пленки гидрогенизир. К., или a-Si:H, получают плазмохим. разложением SiH4, реактивным катодным распылением К. в атмосфере Н2, а также хим. осаждением из газовой фазы с использованием смеси хлоридов К. и Н2. Пленки наращивают на металлич. и стеклянные пластины при 200-400 °С.
].
Профилир. монокристаллы выращивают с помощью спец. формообразователя по способу Степанова, "горизонтальным сдергиванием" со своб. пов-сти расплава, кристаллизацией на спец. дендритных затравках. Поликристаллич. слитки получают направленной кристаллизацией в графитовой изложнице в условиях строго контролируемого тепло-отвода.
Осн. пром. метод получения эпитаксиальных слоев и структур К.-хим. осаждение из газовой фазы с использованием смеси особо чистых SiCl4 и Н2. Процесс проводят в проточных металлич. и кварцевых реакторах при 1250 °С и. атм. давлении с применением индукционного или радиационного нагрева. Эпитаксиальные слои наращивают на ориентированные и прошедшие спец. мех. и хим. обработку подложки из монокристаллич. К., размещаемые на кварцевом или графитовом (с покрытием SiC) пьедестале. Для снижения т-ры эпитаксиального наращивания в качестве источника К. используют SiH2Cl2, а сам процесс проводят при 6,6-9,3 кПа. Применяют также термич. разложение SiH4 (т-ра кристаллизации до 1000-1050 °C). Самую низкую т-ру кристаллизации (700-800 °С) обеспечивает метод мол. эпитаксии - наращивание из мол. пучков, получаемых нагреванием кремниевых заготовок электронным лучом в условиях глубокого вакуума (10-9-10-10 Па). Жидкофазную эпитаксию из р-ра К. в металлич. расплаве (наиб. часто Sn) проводят при 1100-1200°С.
Пленки гидрогенизир. К., или a-Si:H, получают плазмохим. разложением SiH4, реактивным катодным распылением К. в атмосфере Н2, а также хим. осаждением из газовой фазы с использованием смеси хлоридов К. и Н2. Пленки наращивают на металлич. и стеклянные пластины при 200-400 °С.
Определение. Качественно К. обнаруживают по образованию (преим. в кислых средах) коллоидных р-ров гидратированного SiO2, окрашенных солей кремнемолибденовой к-ты H4[Si(Mo3O10)4]. Макроколичества К. (не менее 0,1% по массе) определяют гравиметрически, титриметрически и фотометрически. Гравиметрич. методы основаны на способности К. образовывать гель H2SiO3, к-рый затем высушивают и взвешивают. При титриметрич. определении К. переводят в H2SiF6, титруют щелочью или осаждают в виде малорастворимых солей H4[Si(Mo3O10)4] и определяют Мо в осадке. Большинство фотометрич. методов основано на переводе бесцв. H2SiO3 в желтую кремнемолибденовую к-ту, к-рую и определяют. Микроколичества К. определяют след. методами: эмиссионным спектральным (до 1-10-5 %), нейтронно-активационным (до 1.10-6 %), масс - спектрометрич. (до 1.10-б %), атомно-абсорбционным с непламенной атомизацией (до 1.10-4 %). Применение. К.-один из осн. полупроводниковых материалов в электронике. Приборы на его основе могут работать при т-рах до 200 °С. Его используют для изготовления интегральных схем, диодов, транзисторов, солнечных батарей, фотоприемников, детекторов частиц в ядерной физике и др., а также линз в приборах ИК техники. В металлургии К. применяют как восстановитель (для получения силико-марганца, силикоалюминия и др.), при произ-ве ферросилиция, для раскисления - удаления растворенного в расплавленных металлах кислорода. К.-компонент электротехн. и др. сталей, чугунов, бронз, силуминов. К. и его соед. используют для получения кремнийорг. производных и силицидов ряда металлов. a-Si:H применяют для изготовления солнечных батарей, полевых транзисторов и др. Мировое произ-во К. (без СССР) для нужд полупроводникового приборостроения составляет ок. 5000 т/год поликристаллич. К. и ок. 2200 т/год монокристаллов (1984). К.-биогенный элемент. Он необходим для нормального роста и развития человека, животных, растений и микроорганизмов: является структурным элементом соединит. ткани, связывая макромолекулы мукополисахаридов и коллагена, играет существ. роль в метаболизме мн. растений и морских организмов, влияет на скорость минерализации и препятствует возникновению атеросклероза. Соед. К. токсичны. Вдыхание мельчайших частиц пыли SiO2 и др. соед. К. (напр., асбеста) вызывает опасную профессиональную болезнь - силикоз. К. получен впервые Ж. Л. Гей-Люссаком и Л. Ж. Тенаром в 1811. Лит.: Реньян В. Р.. Технология полупроводникового кремния, пер. с англ., М., 1969; Медведев С. А., Введение в технологию полупроводниковых материалов, М., 1970; Мильвидский М. Г., Полупроводниковые материалы в современной электронике, М., 1986; Нашельский А. Я.. Технология полупроводниковых материалов, М., 1987. М. Г. Мильвидский.
Свойства. Компактный К.- в-во серебристо-серого цвета с металлич. блеском. Кристаллич. решетка устойчивой модификации кубич. гранецентрированная типа алмаза, а=0,54307 нм, пространств. группа Fd3m, z=4. При высоких давлениях существуют др. полиморфные модификации: при 20 ГПа-К. I с тетрагон. решеткой (а=0,4686 нм, с=0,2585 нм), выше 20 ГПа-К. II с кубич. (а=0,644 нм) и К. III с гексагон. (а=0,380 нм, с=0,628 нм). При кристаллизации из газовой фазы на пов-стях с т-рой ниже 600 °С образуется аморфный К. Для кристаллич. Si т. пл. 1415 °С (плавится с уменьшением объема на 9%), т. кип. 3249 °С; плотн. 2,33 г/см3; C0p 20,16 Дж/(моль.К); DH0пл 49,9 кДж/моль, DH0исп 445,2 кДж/моль; S298 18,9 Дж/(моль.К); давление пара 0,046 Па (1415 °С); температурный коэф. линейного расширения 3,72.10-6К-1 (291-1273 К) и -.0,6.10-6 К-1 (84 К); теплопроводность 95,5 Вт/(м.К); р 2,4-107 Ом м (25 °С); т-ра Дебая 645 К; e 12; диамагнетик, магн. восприимчивость — 3,9.10-6. При обычных условиях К. хрупок, выше 800 °С становится пластичным. К. прозрачен для И К излучения при длинах волн l>1 мкм; коэф. преломления 3,565 (l=1,05 мкм), 3,443 (l=2,6 мкм), 3,45 (l= 2-10 мкм); отражат. способность 0,3 (l>1,5 мкм). К. - полупроводник; ширина запрещенной зоны 1,21 эВ при т-ре ок. 0 К и 1,09 эВ при 300 К; концентрация носителей тока в К. с собственной проводимостью 1,5-1016 м-3 (300 К); температурная зависимость подвижности электронов и дырок [м2/(В.с)] определяется соотв. выражениями: mn=4,0.105Т-2,6 (300[T[400 К) и mр = 2,5.104T-2,3 (150[T[400 К); при 300 К mn= 0,145 м2/(В.с), mp=0,048 м2/(В.с), коэф. диффузии электронов 3,5.10-3 м2/с, дырок - 1,3.10-3 м2/с. Электрофиз. св-ва К. зависят от природы и концентрации присутствующих примесей и структурных дефектов. Для получения монокристаллов К. с дырочной проводимостью используют легирующие добавки В, Al, Ga, In (акцепторные примеси), с электронной проводимостью - Р, As, Sb (донорные примеси). Примеси Аu, Сu, Fe, Mn, V и нек-рые др. существенно снижают время жизни носителей тока в монокристаллах К. Макс, р-римость примесей в К. наблюдается при 1200-1300 °С и м. б. грубо оценена по значению коэф. распределения между твердым К. и его расплавом. Акцепторные примеси в К. имеют большие значения коэф. диффузии, чем донорные. Ряд примесей (Li, Сu, Аu) диффундирует по междоузлиям кристаллич. решетки с очень высокими скоростями. Для определения содержания примесей в К. высокой чистоты используют прецизионные методы: спектральный и активационный анализ, метод ЭПР и др. Производят монокристаллы К. без дислокаций диаметром до 0,156 м. Осн. дефекты в таких монокристаллах К.-скопления собств. междоузельных атомов, вакансий и атомов остаточных примесей. Для определения природы и содержания структурных дефектов в К. применяют избират. травление (в осн. смесью к-т: HF, HNO3 и СН3СООН), рентгеновский и др. методы. Электрич. св-ва К. могут сильно изменяться при термич. обработке. Так, нагревание монокристаллов, содержащих кислород, до 400-500 °С приводит к увеличению электронной проводимости, а при послед. нагревании до 1 1000-1200 °С этот эффект пропадает. Обычно термич. обработка приводит к существ. снижению времени жизни носителей тока. Для предотвращения вредного действия термич. обработки используют предварит. обработку пов-сти монокристаллов К. спец. орг. реактивами, отжиг в хлорсодержащей атмосфере, грубую шлифовку, бомбардировку ионами и др. методы. При низких т-рах К. химически инертен, при нагр. его реакц. способность резко возрастает. Особенно активен расплавленный К. Координац. число атома К. 4, иногда 6 (напр., во фторосиликатах, содержащих анион [SiF6]2-). Соед., где К. формально двухвалентен, по-видимому, содержат связь Si—Si и, как правило, полимерны. Благодаря образующейся на пов-сти защитной оксидной пленке К. устойчив на воздухе даже при повыш. т-рах. Окисляется О2 выше 400°С до SiO2 (см. также Кремния оксид). Стоек к действию к-т, взаимод. только со смесью HNO3 и фтористоводородной к-ты. Хорошо реагирует с р-рами щелочей с выделением Н2 и образованием силикатов. Взаимод. с F2 уже при комнатной т-ре, с остальными галогенами - при 300-500 °С с образованием галогенидов SiX4 или Sin,X2n+2 (см. Кремния иодиды, Кремния фториды, Кремния хлориды). С парами S при 600 °С дает дисульфид SiS2, к-рый выше 600 °С переходит в моносульфид SiS; аналогичные, хотя и менее прочные соед., образует с Те и Se. С Н2 К. непосредственно не реагирует, поэтому силаны SinH2n+2 получают косвенным путем - разложением силицидов. Аморфный К. обладает способностью растворять значит. кол-ва разл. газов, прежде всего Н2. При этом образуется твердый р-р (до 47 ат. % водорода), называемый l-Si:H, к-рый обладает полупроводниковыми св-вами. С азотом выше 1000 °С К. образует кремния нитрид Si3N4, с фосфором - фосфид SiP, с мышьяком - арсениды SiAs2 и SiAs, с углеродом -кремния карбид SiC, с бором - термически и химически стойкие бориды SiB3, SiB6 и SiB12. С большинством металлов дает тугоплавкие высокотвердые силициды. Об орг. производных К. см. Кремнийорганические полимеры, Кремнийорганические соединения, Кремнийэлементоорганические соединения.
Получение. К. производят восстановлением расплава SiO2 углеродом в дуговых печах при 1800°С. Чистота техн. продукта после спец. кислотной обработки ок. 99,9%. Очень небольшие кол-ва К. получают электролизом р-ров Na2SiF6 или K2SiF6 в расплавах. Для получения К. высокой чистоты техн. продукт хлорируют до SiQ4 или SiHCl3. Эти хлориды подвергают глубокой очистке ректификацией, сорбцией, путем частичного гидролиза и спец. термич. обработок, а затем восстанавливают при 1200-1300 °С высокочистым Н2 в установках из нержавеющей стали или непрозрачного кварцевого стекла. Восстанавливаемый К. осаждают на прутки из К. высокой чистоты. Др. пром. метод получения К. высокой чистоты основан на разложении ок. 1000 °С SiH4, предварительно очищенного ректификацией. SiH4 синтезируют взаимод. Mg2Si с соляной или уксусной к-той, диспропор-ционированием SiH(OC2H5)3 в присут. Na или р-цией LiAlH4 с SiQ4 в эфире. Перечисл. методами получают К. с суммарным содержанием остаточных примесей 10-7-10-8 % по массе. Монокристаллы К. выращивают по методу Чохральского или бестигельной зонной плавкой (см. Монокристаллов выращивание). В первом случае процесс проводят в кварцевых тиглях в вакууме или инертной атмосфере с применением нагревателей из особо чистого графита. Масса исходной загрузки 60-100 кг, диаметр получаемых монокристаллов до 0,15 м, длина до 1,5-2,0 м. Зонную плавку проводят в глубоком вакууме или атмосфере особо чистого Н2; этим способом получают наиб. чистые монокристаллы. Диаметр монокристаллов до 0,125 м, длина до 1,5 м. Легируют монокристаллы непосредственно в процессе выращивания. Для получения однородных монокристаллов, легированных фосфором, их часто облучают медленными нейтронами [
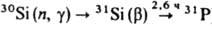 ].
Профилир. монокристаллы выращивают с помощью спец. формообразователя по способу Степанова, "горизонтальным сдергиванием" со своб. пов-сти расплава, кристаллизацией на спец. дендритных затравках. Поликристаллич. слитки получают направленной кристаллизацией в графитовой изложнице в условиях строго контролируемого тепло-отвода.
Осн. пром. метод получения эпитаксиальных слоев и структур К.-хим. осаждение из газовой фазы с использованием смеси особо чистых SiCl4 и Н2. Процесс проводят в проточных металлич. и кварцевых реакторах при 1250 °С и. атм. давлении с применением индукционного или радиационного нагрева. Эпитаксиальные слои наращивают на ориентированные и прошедшие спец. мех. и хим. обработку подложки из монокристаллич. К., размещаемые на кварцевом или графитовом (с покрытием SiC) пьедестале. Для снижения т-ры эпитаксиального наращивания в качестве источника К. используют SiH2Cl2, а сам процесс проводят при 6,6-9,3 кПа. Применяют также термич. разложение SiH4 (т-ра кристаллизации до 1000-1050 °C). Самую низкую т-ру кристаллизации (700-800 °С) обеспечивает метод мол. эпитаксии - наращивание из мол. пучков, получаемых нагреванием кремниевых заготовок электронным лучом в условиях глубокого вакуума (10-9-10-10 Па). Жидкофазную эпитаксию из р-ра К. в металлич. расплаве (наиб. часто Sn) проводят при 1100-1200°С.
Пленки гидрогенизир. К., или a-Si:H, получают плазмохим. разложением SiH4, реактивным катодным распылением К. в атмосфере Н2, а также хим. осаждением из газовой фазы с использованием смеси хлоридов К. и Н2. Пленки наращивают на металлич. и стеклянные пластины при 200-400 °С.
].
Профилир. монокристаллы выращивают с помощью спец. формообразователя по способу Степанова, "горизонтальным сдергиванием" со своб. пов-сти расплава, кристаллизацией на спец. дендритных затравках. Поликристаллич. слитки получают направленной кристаллизацией в графитовой изложнице в условиях строго контролируемого тепло-отвода.
Осн. пром. метод получения эпитаксиальных слоев и структур К.-хим. осаждение из газовой фазы с использованием смеси особо чистых SiCl4 и Н2. Процесс проводят в проточных металлич. и кварцевых реакторах при 1250 °С и. атм. давлении с применением индукционного или радиационного нагрева. Эпитаксиальные слои наращивают на ориентированные и прошедшие спец. мех. и хим. обработку подложки из монокристаллич. К., размещаемые на кварцевом или графитовом (с покрытием SiC) пьедестале. Для снижения т-ры эпитаксиального наращивания в качестве источника К. используют SiH2Cl2, а сам процесс проводят при 6,6-9,3 кПа. Применяют также термич. разложение SiH4 (т-ра кристаллизации до 1000-1050 °C). Самую низкую т-ру кристаллизации (700-800 °С) обеспечивает метод мол. эпитаксии - наращивание из мол. пучков, получаемых нагреванием кремниевых заготовок электронным лучом в условиях глубокого вакуума (10-9-10-10 Па). Жидкофазную эпитаксию из р-ра К. в металлич. расплаве (наиб. часто Sn) проводят при 1100-1200°С.
Пленки гидрогенизир. К., или a-Si:H, получают плазмохим. разложением SiH4, реактивным катодным распылением К. в атмосфере Н2, а также хим. осаждением из газовой фазы с использованием смеси хлоридов К. и Н2. Пленки наращивают на металлич. и стеклянные пластины при 200-400 °С.
Определение. Качественно К. обнаруживают по образованию (преим. в кислых средах) коллоидных р-ров гидратированного SiO2, окрашенных солей кремнемолибденовой к-ты H4[Si(Mo3O10)4]. Макроколичества К. (не менее 0,1% по массе) определяют гравиметрически, титриметрически и фотометрически. Гравиметрич. методы основаны на способности К. образовывать гель H2SiO3, к-рый затем высушивают и взвешивают. При титриметрич. определении К. переводят в H2SiF6, титруют щелочью или осаждают в виде малорастворимых солей H4[Si(Mo3O10)4] и определяют Мо в осадке. Большинство фотометрич. методов основано на переводе бесцв. H2SiO3 в желтую кремнемолибденовую к-ту, к-рую и определяют. Микроколичества К. определяют след. методами: эмиссионным спектральным (до 1-10-5 %), нейтронно-активационным (до 1.10-6 %), масс - спектрометрич. (до 1.10-б %), атомно-абсорбционным с непламенной атомизацией (до 1.10-4 %). Применение. К.-один из осн. полупроводниковых материалов в электронике. Приборы на его основе могут работать при т-рах до 200 °С. Его используют для изготовления интегральных схем, диодов, транзисторов, солнечных батарей, фотоприемников, детекторов частиц в ядерной физике и др., а также линз в приборах ИК техники. В металлургии К. применяют как восстановитель (для получения силико-марганца, силикоалюминия и др.), при произ-ве ферросилиция, для раскисления - удаления растворенного в расплавленных металлах кислорода. К.-компонент электротехн. и др. сталей, чугунов, бронз, силуминов. К. и его соед. используют для получения кремнийорг. производных и силицидов ряда металлов. a-Si:H применяют для изготовления солнечных батарей, полевых транзисторов и др. Мировое произ-во К. (без СССР) для нужд полупроводникового приборостроения составляет ок. 5000 т/год поликристаллич. К. и ок. 2200 т/год монокристаллов (1984). К.-биогенный элемент. Он необходим для нормального роста и развития человека, животных, растений и микроорганизмов: является структурным элементом соединит. ткани, связывая макромолекулы мукополисахаридов и коллагена, играет существ. роль в метаболизме мн. растений и морских организмов, влияет на скорость минерализации и препятствует возникновению атеросклероза. Соед. К. токсичны. Вдыхание мельчайших частиц пыли SiO2 и др. соед. К. (напр., асбеста) вызывает опасную профессиональную болезнь - силикоз. К. получен впервые Ж. Л. Гей-Люссаком и Л. Ж. Тенаром в 1811. Лит.: Реньян В. Р.. Технология полупроводникового кремния, пер. с англ., М., 1969; Медведев С. А., Введение в технологию полупроводниковых материалов, М., 1970; Мильвидский М. Г., Полупроводниковые материалы в современной электронике, М., 1986; Нашельский А. Я.. Технология полупроводниковых материалов, М., 1987. М. Г. Мильвидский.
-капролактам
Keтoальдегиды
Кабачника-филдса реакция
Кавитация
Кадио-ходкевича реакция
Кадионы
Кадмий
Кадмийорганические соединения
Кадмия антимонид
Кадмия галогениды
Кадмия нитрат
Кадмия оксид
Кадмия селенид
Кадмия сульфат
Кадмия сульфид
Кадмия теллурид
Кадмия хлорид
Казеин
Каландрование полимеров
Калий
Калийная селитра
Калийные удобрения
Калифорний
Калия гексацианоферраты
Калия гидрокарбонат
Калия гидроксид
Калия дихромат
Калия дицианоаурат(i)
Калия иодид
Калия карбонат
Калия нитрат
Калия оксид
Калия перманганат
Калия пероксодикарбонат
Калия пероксосульфаты
Калия сульфат
Калия сульфиды
Калия фосфаты
Калия фторид
Калия хлорид
Калия цианат
Калия цианид
Калия этилксантогенат
Каломель
Каломельный электрод
Калориметрия
Кальмодулин
Кальциевая селитра
Кальций
Кальцийорганические соединения
Кальцитонин
Кальциферолы
Кальция алюминаты
Кальция бораты
Кальция вольфраматы
Кальция галогениды
Кальция гидроксид
Кальция гипохлорит
Кальция карбид
Кальция карбонат
Кальция нитрат
Кальция оксид
Кальция силикаты
Кальция сульфат
Кальция фосфаты
Кальция фторид
Кальция хлорид
Кальция цианамид
Каменноугольная смола
Каменноугольные масла
Каменные угли
Камфан
Камфен
Камфеновые перегруппировки
Камфора
Канатные смазки
Канифоль
Канниццаро реакция
Канцерогенные вещества
Каолин
Капельный анализ
Капиллярная конденсация
Капиллярная хроматография
Капиллярные явления
Капиллярный осмос
Каплеулавливание
Каприловая кислота
Капрон
Капроновая кислота
Капсаицин
Капсулирование
Каптакс
Карбазол
Карбамид
Карбамидные смолы
Карбаминовая кислота
Карбанионы
Карбеновые комплексы переходных металлов
Карбены
Карбиды
Карбиламины
Карбин
Карбиновые комплексы переходных металлов
Карбитолы
Карбкатионы
Карбодиимиды
Карбодифосфораны
Карбоксилатные каучуки
Карбоксилирование
Карбоксиметилцеллюлоза
Карбоксипептидазы
Карбоксиэстеразы
Карболины
Карбонаты неорганические
Карбонаты органические
Карбонаты природные
Карбонизация
Карбонилирование
Карбонилфторид
Карбонилы металлов
Карбонильные соединения
Карбония ионы
Карбоновые кислоты
Карбопласты
Карборансодержащие полимеры
Карбораны
Карборунд
Карбоциклические соединения
Карвон
Кардовые полимеры
Карены
Кариофиллен
Кариуса метод
Каркасные соединения
Карнаубский воск
Карнитин
Карнозин
Каротиноиды
Каррагинаны
Касторовое масло
Катаболизм
Катализ
Катализаторы
Катализаторы гидрирования
Катализаторы дегидрирования
Катализаторы окисления
Катализаторы полимеризации
Каталитический крекинг
Каталитический реформинг
Каталитических реакций кинетика
Катапины
Катенаны
Катепсины
Катехоламины
Катион-радикалы
Катиониты
Катионная полимеризация
Катионные красители
Катионообменные смолы
Катионотропные перегруппировки
Катионы
Катодная защита
Катодолюминесцентный микроанализ
Каустобиолиты
Каучук натуральный
Каучуки синтетические
Качественный анализ
Квадрупольный момент
Квазикристалл
Квазирацематы
Квазистационарности приближение
Квантовая механика
Квантовая химия
Квантовое состояние
Квантовые переходы
Квантовый выход
Кварц
Кварцевое стекло
Квасцы
Кверцетин
Кедровое масло
Керамика
Кератины
Кермель
Керметы
Керосин
Керра эффект
Кетали
Кетены
Кетимины
Кетокарбoновые кислoты
Кетокислоты
Кетон малины
Кетоны
Кибернетика
Кижнера реакция
Кижнера-вольфа реакция
Килиани-фишера реакция
Кинe-замещeние
Кинетика химическая
Кинетическая кривая
Кинетическая теория газов
Кинетические методы анализа
Кинетический изотопный эффект
Кинетическое уравнение
Кинины
Киноплёнки
Кипение
Кипреналь
Кипящий слой
Кирсанова реакция
Кирхгофа уравнение
Кислoтно-оснoвное титрование
Кислoтно-основнoй катализ
Кислород
Кислорода фториды
Кислородный индекс
Кислотное число
Кислотные красители
Кислотоупoрные прирoдные материалы
Кислоты и основания
Кислоты неорганические
Клeя-киннера-пeррена реакция
Клайзена конденсация
Клайзена перегруппировка
Клайзена-шмидта реакция
Клапейрона-клаузиуса уравнение
Клапейрона-менделеева уравнение
Кларки химических элементов
Классификация
Классификация гидравлическая
Кластеры
Клатраты
Клеевые краски
Клеи природные
Клеи синтетические
Клей
Клей неорганические
Клемменсена реакция
Клетки эффект
Клешневидные соединения
Клофелин
Клофибрат
Кнорра реакция
Кнёвенагеля реакция
Коагулянты
Коагуляция
Коалесценция
Коацервация
Кобальта ацетат
Кобальта галогениды
Кобальта гидроксиды
Кобальта карбонаты
Кобальта карбонилы
Кобальта нитраты
Кобальта оксиды
Кобальта сплавы
Кобальта сульфаты
Кобальта хлориды
Кобальтовые удобрения
Кобальторганические соединения
Кобамидные коферменты
Ковалентная связь
Ковалентные кристаллы
Ковалентные радиусы
Ковар
Когезия
Кодеин
Кодон
Кожа
Кожа искусственная
Койевая кислота
Кокаин
Кокосовое масло
Кокс каменноугольный
Кокс нефтяной
Кокс пековый
Коксование
Коксовое число
Коксохимия
Коксуемость углей
Колебательные реакции
Колебательные спектры
Количественный анализ
Коллoидные раствoры
Коллаген
Коллидины
Коллоидная химия
Коллоидные системы
Коллоксилин
Колориметрический анализ
Колхициновые алкалоиды
Кольбе реакции
Кольбе шмитта реакция
Кольрауша закон
Комбинационного рассеяния спектроскопия
Компаунды полимерные
Компенсационный эффект
Комплексные соединения
Комплексометрия
Комплексонометрия
Комплексоны
Комплексообразующие ионообменные смолы
Комплемент
Комплементарность
Композиты
Композиционные материалы
Компонент системы
Компрессорные масла
Компрессорные машины
Компьютерный синтез
Конго красный
Кондакова реакция
Конденсации реакции
Конденсация
Конденсация фракционная
Кондуктометрия
Конкурирующих реакций метод
Коновалова законы
Коновалова реакция
Конопляное масло
Консервационные масла
Консервационные смазки
Консистентные смазки
Константа равновесия
Константа скорости
Константан
Конструкционная керамика
Контакт петрова
Контактная очистка
Конфигурационного взаимодействия метод
Конфигурация стереохимическая
Конформации молекулы
Конформационные эффекты
Конформационный анализ
Концентрация
Концентрирование
Координата реакции
Координациoнно-иoнная полимеризация
Координационная связь
Координационное число
Координационные полимеры
Координационные полиэдры
Координационные соединения
Копалы
Кордиты
Коричный альдегид
Коричный спирт
Кормовые фосфаты
Корреляционные соотношения
Корреляция конфигураций
Корриноиды
Коррозионная усталость
Коррозионностойкие материалы
Коррозионные испытания
Коррозия металлов
Коррозия под напряжением
Кортикоиды
Коршун климовой метод
Космические смазки
Космохимия
Котельные топлива
Коттона эффект
Кофеин
Кофермент
Коферменты
Коха-хаафа реакция
Коэрцитивная сила
Крапплак
Красители природные
Красители синтетические
Краски
Красуского правило
Кратные связи
Краун-эфиры
Крахмал
Крашение бумаги
Крашение волокон
Крашение древесины
Крашение кожи
Крашение меха
Крашение оксидированного алюминия
Крашение пластических масс
Крашение резино-технических изделий
Креатинфосфорная кислота
Кребса цикл
Крезолы
Крекинг
Кремнефтористоводородная кислота
Кремниевые кислоты
Кремний
Кремнийорганические жидкости
Кремнийорганические каучуки
Кремнийорганические лаки
Кремнийорганические полимеры
Кремнийорганические соединения
Кремнийэлементоорганические соединения
Кремния диоксид
Кремния иодиды
Кремния карбид
Кремния нитрид
Кремния оксид
Кремния фториды
Кремния хлориды
Криоскопия
Криохимия
Криптанды
Криптон
Криптона дифторид
Кристаллизационные методы разделения смесей
Кристаллизация
Кристаллическая структура
Кристаллический фиолетовый
Кристаллического поля теория
Кристаллическое состояние
Кристаллическое состояние полимеров
Кристаллогидраты
Кристаллосольваты
Кристаллофосфоры
Кристаллохимия
Кристаллы
Критические явления
Критическое состояние
Кровезаменители
Кроны
Кротоновая кислота
Кротоновая конденсация
Кротоновый альдегид
Круговой дихроизм
Крёнке реакция
Ксаитемовые красители
Ксантин
Ксантинола никотинат
Ксантогенаты
Ксантопротеиновая реакция
Ксантотоксин
Ксенон
Ксенона фториды
Ксиленоловый оранжевый
Ксилидины
Ксилилендиамины
Ксилит
Ксилолы
Кубовые красители
Кубогены
Кубозоли
Кукурузное масло
Кулонометрия
Кумарин
Кумароно-инденовые смолы
Кумилгидропероксид
Кумилпероксид
Кумол
Кумулены
Кунжутное масло
Купманса теорема
Купферон
Курареподобные средства
Курарин
Курнакова соединения
Курциуса реакция
Курчатовий
Кучерова реакция
Кьельдаля метод
Кэмпса реакция
Кэрролла-каймела реакция
Кюри точка
Кюрий
Кёнигса-кнорра реакция

