Словарь научных терминов
Кислоты неорганические
КИСЛОТЫ НЕОРГАНИЧЕСКИЕ, неорг. в-ва, молекулы к-рых при электролитич. диссоциации в водной среде отщепляют протоны, в результате чего в р-ре образуются
гидроксоний-катионы Н3О+ и анионы кислотных остатков А-:
НА+Н2ОDН3О++А (1)
Исключение составляет борная к-та В(ОН)3, к-рая акцептирует ионы ОН-, в результате чего в водном р-ре создается избыток гидроксоний-катионов:
В(ОН)3+2Н2ОD[В(ОН)4]-+Н3О+
Число отщепляемых от молекулы к-ты протонов наз. основностью к-ты. Теории к-т и оснований (Брёнстеда, Льюиса и др.) кроме указанных выше относят к к-там мн. иные соед. (см. Кислоты и основания). Общее св-во к-т - способность реагировать с основаниями и основными оксидами с образованием солей, напр.:
HNO3+NaOH:NaNO3+Н2О 2НСl+CaO:CaCl2+H2O
К. н. подразделяют на кислородсодержащие (оксокислоты) общей ф-лы НnЭОm, где Э - кислотообразующий элемент, и бескислородные НnХ, где X - галоген, халькоген или неорг. бескислородный радикал (CN, NCS, N3 и др.). Оксокислоты характерны для мн. хим. элементов, особенно для элементов в высоких ( +3 и выше) степенях окисления. Атомы Н в оксокислотах обычно связаны с кислородом. Если в оксокислоте имеются атомы Н, не связанные с кислородом (напр., два атома Н, образующие связи Р—Н в Н3РО2), то они не отщепляются в водном р-ре с образованием Н3О+ и не принимают участия в р-ции к-т с основаниями. Нек-рые к-ты известны в двух таутомерных формах, различающихся положением атома Н, напр.:
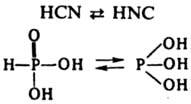
Молекулы мн. к-т содержат более одного атома кислотообразующего элемента Э. Очень многочисленны изополикислоты, содержащие атомы Э, связанные через атом кислорода, причем фрагменты —Э—О—Э— могут образовать как открытые цепи (напр., в Н4Р2О7), так и циклич. структуры [напр., в (HPO3)n]. В нек-рых к-тах содержатся цепи из одинаковых атомов, напр., цепи —S—S— в политионовых к-тах Н2SnО6 и сульфанах Н2Sn. Известны гетерополикислоты (см. Гетерополисоединения), имеющие фрагменты —Э—О—Э'—, где Э и Э' - атомы двух разных элементов, напр.: H4[SiW12O40].14H2O. Существует множество комплексных к-т, напр.: H2[SiF6], H[AuCl4], H4[Fe(CN)6]. К-ты, аналогичные оксокислотам, но содержащие вместо атома (атомов) кислорода серу, наз. тиокислотами, напр. H2S2O3, H3AsS3. Пероксокислоты, напр. H2S2O8, имеют пероксогруппы —О—О— (см. Пероксидные соединения неорганические). Константу равновесия р-ции (1) называют константой кислотности Ка. Многоосновные к-ты диссоциируют ступенчато, каждой ступени отвечает своя Ка, причем всегда Ka(1)>>Kа(2)...; ориентировочно каждая послед. Ка меньше предыдущей на 5 порядков. По значению pK1=-lgKa(1) К. н. подразделяют на очень слабые, слабые, средней силы, сильные, очень сильные (см. Кислоты и основания). Согласно правилу Полинга, для очень слабых оксокислот НnЭОm разность m-n=0, для слабых, сильных и очень сильных эта разность составляет соотв. 1, 2 и 3. Данная закономерность обусловлена сдвигом электронной плотности от связи Н—О к связям Э=О (содержащим атом О с большим значением электроотрицательности) и делокализацией электронной плотности в анионе. Для характеристики кислотности в-в в неводных средах используют ф-цию кислотности Гаммета H0 (см. Корреляционные соотношения). Известны жидкости, для к-рых H0 более отрицательна, чем для конц. водных р-ров очень сильных к-т, таких, как HNO3, H2SO4. Эти жидкости наз. сверхкислотами. Примеры: 100%-ная H2SO4 (H0=-12), безводная фторсульфоновая к-та HSO3F (H0=-15), смесь HF и SbF5 (H0=-17), 7%-ный р-р SbF5 в HSO3F (H0=-19,4). Эквимолярную смесь HSO3F и SbF5 называют "магической к-той". Сверхкислотность обусловлена исключительной слабостью взаимод. с протоном соответствующих анионов (HSO-4, SbF-6 и др.). В среде сверхкислот протонируются в-ва, обычно не проявляющие основных св-в, в частности углеводороды. Это явление используют на практике, преим. в орг. синтезе (алкилирование по Фриделю - Крафтсу, гидрирование нефти и др.). Мн. оксокислоты (HNO3, HMnO4, Н2Сr2О7, НСlO и др.) - сильные окислители. окислит. активность этих к-т в водном р-ре выражена сильнее, чем у их солей. Все пероксокислоты - сильные окислители. К. н. всегда менее термически устойчивы, чем их соли, образованные активными металлами (Na, К и др.). Нек-рые К. н. (Н2СО3, H2SO3, НСlO и др.) невозможно выделить в виде индивидуальных соед., эти К. н. существуют только в р-ре. Общие методы получения К. н.: взаимод. оксидов (ангидридов) с водой, напр.:
Р2О5+Н2О:Н3РО4
вытеснение более летучей К. н. из ее соли менее летучей К. н., напр.:
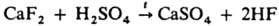
действие H2SO4 на р-р бариевой соли данной К. н., напр.:
Ва(Н2РО2)2+H2SO4:BaSO4+2Н3РО2
гидролиз галогенидов или солей, напр.:
Рl3+ЗН2O:Н3РO3+3HI Аl2Sе3+6Н2O:2Аl(ОН)3+3H2Se
замена катионов растворенных солей на Н с помощью катионита. Существует также множество др. методов получения К. н. К. н. применяют в пром-сти и в научных исследованиях. В больших кол-вах производят серную кислоту, азотную кислоту, фосфорную кислоту, соляную кислоту и др. Лит.: Некрасов Б. В., Основы обшей химии, 3 изд., т. 1-2, М., 1973; Кемпбел Дж., Современная общая химия, пер. с англ., т. 1-3, М., 1975; Белл Р., Протон в химии, пер. с англ., М., 1977; Хьюи Д., Неорганическая химия, пер. с англ., М., 1987. С. И. Дракин.
НА+Н2ОDН3О++А (1)
Исключение составляет борная к-та В(ОН)3, к-рая акцептирует ионы ОН-, в результате чего в водном р-ре создается избыток гидроксоний-катионов:
В(ОН)3+2Н2ОD[В(ОН)4]-+Н3О+
Число отщепляемых от молекулы к-ты протонов наз. основностью к-ты. Теории к-т и оснований (Брёнстеда, Льюиса и др.) кроме указанных выше относят к к-там мн. иные соед. (см. Кислоты и основания). Общее св-во к-т - способность реагировать с основаниями и основными оксидами с образованием солей, напр.:
HNO3+NaOH:NaNO3+Н2О 2НСl+CaO:CaCl2+H2O
К. н. подразделяют на кислородсодержащие (оксокислоты) общей ф-лы НnЭОm, где Э - кислотообразующий элемент, и бескислородные НnХ, где X - галоген, халькоген или неорг. бескислородный радикал (CN, NCS, N3 и др.). Оксокислоты характерны для мн. хим. элементов, особенно для элементов в высоких ( +3 и выше) степенях окисления. Атомы Н в оксокислотах обычно связаны с кислородом. Если в оксокислоте имеются атомы Н, не связанные с кислородом (напр., два атома Н, образующие связи Р—Н в Н3РО2), то они не отщепляются в водном р-ре с образованием Н3О+ и не принимают участия в р-ции к-т с основаниями. Нек-рые к-ты известны в двух таутомерных формах, различающихся положением атома Н, напр.:
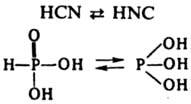
Молекулы мн. к-т содержат более одного атома кислотообразующего элемента Э. Очень многочисленны изополикислоты, содержащие атомы Э, связанные через атом кислорода, причем фрагменты —Э—О—Э— могут образовать как открытые цепи (напр., в Н4Р2О7), так и циклич. структуры [напр., в (HPO3)n]. В нек-рых к-тах содержатся цепи из одинаковых атомов, напр., цепи —S—S— в политионовых к-тах Н2SnО6 и сульфанах Н2Sn. Известны гетерополикислоты (см. Гетерополисоединения), имеющие фрагменты —Э—О—Э'—, где Э и Э' - атомы двух разных элементов, напр.: H4[SiW12O40].14H2O. Существует множество комплексных к-т, напр.: H2[SiF6], H[AuCl4], H4[Fe(CN)6]. К-ты, аналогичные оксокислотам, но содержащие вместо атома (атомов) кислорода серу, наз. тиокислотами, напр. H2S2O3, H3AsS3. Пероксокислоты, напр. H2S2O8, имеют пероксогруппы —О—О— (см. Пероксидные соединения неорганические). Константу равновесия р-ции (1) называют константой кислотности Ка. Многоосновные к-ты диссоциируют ступенчато, каждой ступени отвечает своя Ка, причем всегда Ka(1)>>Kа(2)...; ориентировочно каждая послед. Ка меньше предыдущей на 5 порядков. По значению pK1=-lgKa(1) К. н. подразделяют на очень слабые, слабые, средней силы, сильные, очень сильные (см. Кислоты и основания). Согласно правилу Полинга, для очень слабых оксокислот НnЭОm разность m-n=0, для слабых, сильных и очень сильных эта разность составляет соотв. 1, 2 и 3. Данная закономерность обусловлена сдвигом электронной плотности от связи Н—О к связям Э=О (содержащим атом О с большим значением электроотрицательности) и делокализацией электронной плотности в анионе. Для характеристики кислотности в-в в неводных средах используют ф-цию кислотности Гаммета H0 (см. Корреляционные соотношения). Известны жидкости, для к-рых H0 более отрицательна, чем для конц. водных р-ров очень сильных к-т, таких, как HNO3, H2SO4. Эти жидкости наз. сверхкислотами. Примеры: 100%-ная H2SO4 (H0=-12), безводная фторсульфоновая к-та HSO3F (H0=-15), смесь HF и SbF5 (H0=-17), 7%-ный р-р SbF5 в HSO3F (H0=-19,4). Эквимолярную смесь HSO3F и SbF5 называют "магической к-той". Сверхкислотность обусловлена исключительной слабостью взаимод. с протоном соответствующих анионов (HSO-4, SbF-6 и др.). В среде сверхкислот протонируются в-ва, обычно не проявляющие основных св-в, в частности углеводороды. Это явление используют на практике, преим. в орг. синтезе (алкилирование по Фриделю - Крафтсу, гидрирование нефти и др.). Мн. оксокислоты (HNO3, HMnO4, Н2Сr2О7, НСlO и др.) - сильные окислители. окислит. активность этих к-т в водном р-ре выражена сильнее, чем у их солей. Все пероксокислоты - сильные окислители. К. н. всегда менее термически устойчивы, чем их соли, образованные активными металлами (Na, К и др.). Нек-рые К. н. (Н2СО3, H2SO3, НСlO и др.) невозможно выделить в виде индивидуальных соед., эти К. н. существуют только в р-ре. Общие методы получения К. н.: взаимод. оксидов (ангидридов) с водой, напр.:
Р2О5+Н2О:Н3РО4
вытеснение более летучей К. н. из ее соли менее летучей К. н., напр.:
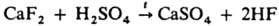
действие H2SO4 на р-р бариевой соли данной К. н., напр.:
Ва(Н2РО2)2+H2SO4:BaSO4+2Н3РО2
гидролиз галогенидов или солей, напр.:
Рl3+ЗН2O:Н3РO3+3HI Аl2Sе3+6Н2O:2Аl(ОН)3+3H2Se
замена катионов растворенных солей на Н с помощью катионита. Существует также множество др. методов получения К. н. К. н. применяют в пром-сти и в научных исследованиях. В больших кол-вах производят серную кислоту, азотную кислоту, фосфорную кислоту, соляную кислоту и др. Лит.: Некрасов Б. В., Основы обшей химии, 3 изд., т. 1-2, М., 1973; Кемпбел Дж., Современная общая химия, пер. с англ., т. 1-3, М., 1975; Белл Р., Протон в химии, пер. с англ., М., 1977; Хьюи Д., Неорганическая химия, пер. с англ., М., 1987. С. И. Дракин.
-капролактам
Keтoальдегиды
Кабачника-филдса реакция
Кавитация
Кадио-ходкевича реакция
Кадионы
Кадмий
Кадмийорганические соединения
Кадмия антимонид
Кадмия галогениды
Кадмия нитрат
Кадмия оксид
Кадмия селенид
Кадмия сульфат
Кадмия сульфид
Кадмия теллурид
Кадмия хлорид
Казеин
Каландрование полимеров
Калий
Калийная селитра
Калийные удобрения
Калифорний
Калия гексацианоферраты
Калия гидрокарбонат
Калия гидроксид
Калия дихромат
Калия дицианоаурат(i)
Калия иодид
Калия карбонат
Калия нитрат
Калия оксид
Калия перманганат
Калия пероксодикарбонат
Калия пероксосульфаты
Калия сульфат
Калия сульфиды
Калия фосфаты
Калия фторид
Калия хлорид
Калия цианат
Калия цианид
Калия этилксантогенат
Каломель
Каломельный электрод
Калориметрия
Кальмодулин
Кальциевая селитра
Кальций
Кальцийорганические соединения
Кальцитонин
Кальциферолы
Кальция алюминаты
Кальция бораты
Кальция вольфраматы
Кальция галогениды
Кальция гидроксид
Кальция гипохлорит
Кальция карбид
Кальция карбонат
Кальция нитрат
Кальция оксид
Кальция силикаты
Кальция сульфат
Кальция фосфаты
Кальция фторид
Кальция хлорид
Кальция цианамид
Каменноугольная смола
Каменноугольные масла
Каменные угли
Камфан
Камфен
Камфеновые перегруппировки
Камфора
Канатные смазки
Канифоль
Канниццаро реакция
Канцерогенные вещества
Каолин
Капельный анализ
Капиллярная конденсация
Капиллярная хроматография
Капиллярные явления
Капиллярный осмос
Каплеулавливание
Каприловая кислота
Капрон
Капроновая кислота
Капсаицин
Капсулирование
Каптакс
Карбазол
Карбамид
Карбамидные смолы
Карбаминовая кислота
Карбанионы
Карбеновые комплексы переходных металлов
Карбены
Карбиды
Карбиламины
Карбин
Карбиновые комплексы переходных металлов
Карбитолы
Карбкатионы
Карбодиимиды
Карбодифосфораны
Карбоксилатные каучуки
Карбоксилирование
Карбоксиметилцеллюлоза
Карбоксипептидазы
Карбоксиэстеразы
Карболины
Карбонаты неорганические
Карбонаты органические
Карбонаты природные
Карбонизация
Карбонилирование
Карбонилфторид
Карбонилы металлов
Карбонильные соединения
Карбония ионы
Карбоновые кислоты
Карбопласты
Карборансодержащие полимеры
Карбораны
Карборунд
Карбоциклические соединения
Карвон
Кардовые полимеры
Карены
Кариофиллен
Кариуса метод
Каркасные соединения
Карнаубский воск
Карнитин
Карнозин
Каротиноиды
Каррагинаны
Касторовое масло
Катаболизм
Катализ
Катализаторы
Катализаторы гидрирования
Катализаторы дегидрирования
Катализаторы окисления
Катализаторы полимеризации
Каталитический крекинг
Каталитический реформинг
Каталитических реакций кинетика
Катапины
Катенаны
Катепсины
Катехоламины
Катион-радикалы
Катиониты
Катионная полимеризация
Катионные красители
Катионообменные смолы
Катионотропные перегруппировки
Катионы
Катодная защита
Катодолюминесцентный микроанализ
Каустобиолиты
Каучук натуральный
Каучуки синтетические
Качественный анализ
Квадрупольный момент
Квазикристалл
Квазирацематы
Квазистационарности приближение
Квантовая механика
Квантовая химия
Квантовое состояние
Квантовые переходы
Квантовый выход
Кварц
Кварцевое стекло
Квасцы
Кверцетин
Кедровое масло
Керамика
Кератины
Кермель
Керметы
Керосин
Керра эффект
Кетали
Кетены
Кетимины
Кетокарбoновые кислoты
Кетокислоты
Кетон малины
Кетоны
Кибернетика
Кижнера реакция
Кижнера-вольфа реакция
Килиани-фишера реакция
Кинe-замещeние
Кинетика химическая
Кинетическая кривая
Кинетическая теория газов
Кинетические методы анализа
Кинетический изотопный эффект
Кинетическое уравнение
Кинины
Киноплёнки
Кипение
Кипреналь
Кипящий слой
Кирсанова реакция
Кирхгофа уравнение
Кислoтно-оснoвное титрование
Кислoтно-основнoй катализ
Кислород
Кислорода фториды
Кислородный индекс
Кислотное число
Кислотные красители
Кислотоупoрные прирoдные материалы
Кислоты и основания
Кислоты неорганические
Клeя-киннера-пeррена реакция
Клайзена конденсация
Клайзена перегруппировка
Клайзена-шмидта реакция
Клапейрона-клаузиуса уравнение
Клапейрона-менделеева уравнение
Кларки химических элементов
Классификация
Классификация гидравлическая
Кластеры
Клатраты
Клеевые краски
Клеи природные
Клеи синтетические
Клей
Клей неорганические
Клемменсена реакция
Клетки эффект
Клешневидные соединения
Клофелин
Клофибрат
Кнорра реакция
Кнёвенагеля реакция
Коагулянты
Коагуляция
Коалесценция
Коацервация
Кобальта ацетат
Кобальта галогениды
Кобальта гидроксиды
Кобальта карбонаты
Кобальта карбонилы
Кобальта нитраты
Кобальта оксиды
Кобальта сплавы
Кобальта сульфаты
Кобальта хлориды
Кобальтовые удобрения
Кобальторганические соединения
Кобамидные коферменты
Ковалентная связь
Ковалентные кристаллы
Ковалентные радиусы
Ковар
Когезия
Кодеин
Кодон
Кожа
Кожа искусственная
Койевая кислота
Кокаин
Кокосовое масло
Кокс каменноугольный
Кокс нефтяной
Кокс пековый
Коксование
Коксовое число
Коксохимия
Коксуемость углей
Колебательные реакции
Колебательные спектры
Количественный анализ
Коллoидные раствoры
Коллаген
Коллидины
Коллоидная химия
Коллоидные системы
Коллоксилин
Колориметрический анализ
Колхициновые алкалоиды
Кольбе реакции
Кольбе шмитта реакция
Кольрауша закон
Комбинационного рассеяния спектроскопия
Компаунды полимерные
Компенсационный эффект
Комплексные соединения
Комплексометрия
Комплексонометрия
Комплексоны
Комплексообразующие ионообменные смолы
Комплемент
Комплементарность
Композиты
Композиционные материалы
Компонент системы
Компрессорные масла
Компрессорные машины
Компьютерный синтез
Конго красный
Кондакова реакция
Конденсации реакции
Конденсация
Конденсация фракционная
Кондуктометрия
Конкурирующих реакций метод
Коновалова законы
Коновалова реакция
Конопляное масло
Консервационные масла
Консервационные смазки
Консистентные смазки
Константа равновесия
Константа скорости
Константан
Конструкционная керамика
Контакт петрова
Контактная очистка
Конфигурационного взаимодействия метод
Конфигурация стереохимическая
Конформации молекулы
Конформационные эффекты
Конформационный анализ
Концентрация
Концентрирование
Координата реакции
Координациoнно-иoнная полимеризация
Координационная связь
Координационное число
Координационные полимеры
Координационные полиэдры
Координационные соединения
Копалы
Кордиты
Коричный альдегид
Коричный спирт
Кормовые фосфаты
Корреляционные соотношения
Корреляция конфигураций
Корриноиды
Коррозионная усталость
Коррозионностойкие материалы
Коррозионные испытания
Коррозия металлов
Коррозия под напряжением
Кортикоиды
Коршун климовой метод
Космические смазки
Космохимия
Котельные топлива
Коттона эффект
Кофеин
Кофермент
Коферменты
Коха-хаафа реакция
Коэрцитивная сила
Крапплак
Красители природные
Красители синтетические
Краски
Красуского правило
Кратные связи
Краун-эфиры
Крахмал
Крашение бумаги
Крашение волокон
Крашение древесины
Крашение кожи
Крашение меха
Крашение оксидированного алюминия
Крашение пластических масс
Крашение резино-технических изделий
Креатинфосфорная кислота
Кребса цикл
Крезолы
Крекинг
Кремнефтористоводородная кислота
Кремниевые кислоты
Кремний
Кремнийорганические жидкости
Кремнийорганические каучуки
Кремнийорганические лаки
Кремнийорганические полимеры
Кремнийорганические соединения
Кремнийэлементоорганические соединения
Кремния диоксид
Кремния иодиды
Кремния карбид
Кремния нитрид
Кремния оксид
Кремния фториды
Кремния хлориды
Криоскопия
Криохимия
Криптанды
Криптон
Криптона дифторид
Кристаллизационные методы разделения смесей
Кристаллизация
Кристаллическая структура
Кристаллический фиолетовый
Кристаллического поля теория
Кристаллическое состояние
Кристаллическое состояние полимеров
Кристаллогидраты
Кристаллосольваты
Кристаллофосфоры
Кристаллохимия
Кристаллы
Критические явления
Критическое состояние
Кровезаменители
Кроны
Кротоновая кислота
Кротоновая конденсация
Кротоновый альдегид
Круговой дихроизм
Крёнке реакция
Ксаитемовые красители
Ксантин
Ксантинола никотинат
Ксантогенаты
Ксантопротеиновая реакция
Ксантотоксин
Ксенон
Ксенона фториды
Ксиленоловый оранжевый
Ксилидины
Ксилилендиамины
Ксилит
Ксилолы
Кубовые красители
Кубогены
Кубозоли
Кукурузное масло
Кулонометрия
Кумарин
Кумароно-инденовые смолы
Кумилгидропероксид
Кумилпероксид
Кумол
Кумулены
Кунжутное масло
Купманса теорема
Купферон
Курареподобные средства
Курарин
Курнакова соединения
Курциуса реакция
Курчатовий
Кучерова реакция
Кьельдаля метод
Кэмпса реакция
Кэрролла-каймела реакция
Кюри точка
Кюрий
Кёнигса-кнорра реакция

