Кристаллы
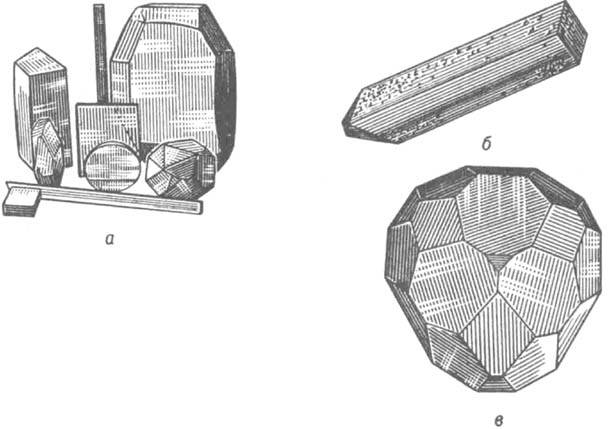
Рис. 1: а - нек-рые синтетич. монокристаллы и изделия из них (кварц, гранат, КН2РО4, алюмокалиевые квасцы и др., стержни рубина для лазеров, сапфировые пластинки); б - кристалл аспартат-трансаминазы (длина ~1 мм); в - микромонокристалл Ge (размер ~5 мкм).
и определяемая ею внеш. огранка. К., выросший в неравновесных условиях и не имеющий правильной огранки (или потерявший ее в результате обработки), сохраняет кристаллич. структуру и все определяемые ею св-ва. На макроуровне, т.е. при измерении участков К., существенно превышающих расстояния между атомами и размеры элементарных ячеек, К. можно рассматривать как сплошную однородную твердую среду, физ., физ.-хим. и др. св-ва к-рой обладают анизотропией и симметрией.
Большинство твердых материалов является поликристаллическими; они состоят из множества отдельных беспорядочно ориентированных мелких кристаллич. зерен (кристаллитов), напр. мн. горные породы, техн. металлы и сплавы. Крупные отдельные однородные К. с непрерывной кристаллич. решеткой называют монокристаллами. Таковы К. минералов, напр. громадные (до сотен кг) К. кварца (горного хрусталя), флюорита, кальцита, полевого шпата или относительно мелкие К. берилла, алмаза и др. К. образуются и растут чаще всего из жидкой фазы - р-ра или расплава; возможно получение К. из газовой фазы или при фазовом превращ. в твердой фазе (см. Кристаллизация, Монокристаллов выращивание). Существуют пром. и лаб. методы выращивания синтетич. К. - аналогов прир. К. (кварц, рубин, алмаз и др.) и разл. техн. К., напр. Si, Ge, лейкосапфира, гранатов. К. образуются и из таких прир. в-в, как белки, нуклеиновые к-ты, а также из вирусов. При определенных условиях можно получить К. синтетич. полимеров.
Осн. методы исследования К., их атомной структуры и ее дефектов - рентгенография, нейтронография, электронография, электронная микроскопия; используют также оптич. и спектроскопич. методы, в т.ч. ЭПР, ЯМР, электронную и мёссбауэровскую спектроскопии и др.
Геометрия К. Выросшие в равновесных условиях К. имеют форму правильных многогранников той или иной симметрии. Два осн. закона геом. кристаллографии - Стенона (Стено) и Гаюи. Первый (закон постоянства углов) гласит: углы между соответствующими гранями К. одного и того же в-ва постоянны, грани при росте К. передвигаются параллельно самим себе. Закон рациональных параметров Гаюи утверждает, что если принять за оси координат три непараллельных ребра К., то расположение любой грани кристалла можно задать целыми числами. Одна из граней К. р'1 р'2 p'3 условно выбирается как единичная (рис. 2); отрезки Ор1(а), Ор2(b) и Ор3(с), отсекаемые этой гранью на координатных ребрах, принимаются за единицы измерения вдоль осей координат. В общем случае оси координат не ортогональны и а№b№с. Отрезки, отсекаемые на осях координат любой гранью К., относятся как целые числа p1, p3, p3, т.е. могут быть выражены как кратные нек-рых осевых единиц а, b, с. Эти геом. законы привели к выводу о существовании кристаллич. решетки, что подтвердилось после открытия дифракции рентгеновских лучей. Гониометрия - измерение межгранных углов К. - являлась до нач. 20 в. осн. методом описания К., их идентификации, однако затем она практически потеряла свое значение благодаря появлению рентгеноструктурного анализа.
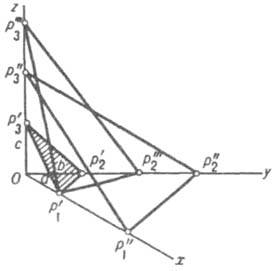
Рис. 2. Графич. изображение расположения граней в кристалле.
Атомная структура К. описывается как совокупность повторяющихся в пространстве одинаковых элементарных ячеек, имеющих форму параллелепипедов с ребрами а, b, с (периоды кристаллич. решетки). Расположение атомных плоскостей кристаллич. решетки (к-рым могут соответствовать и грани К.) характеризуется кристаллографич. индексами (или индексами Миллера). Они связаны с отсекаемыми соответствующей плоскостью на трех осях кристаллографич. системы координат отрезками, длины к-рых p1, р2 и p3 выражены в постоянных решетки а, b, с. Если величины, обратные p1, р2 и р3, привести к общему знаменателю, а затем отбросить его, то полученные три целых числа h=р2p3, k=p1p3, l=p1p2 и естъ индексы Миллера. Они записываются в круглых скобках (hkl). Как правило, К. имеет грани с малыми значениями индексов, напр. (100), (110), (311). Равенство нулю одного или двух индексов означает, что плоскости параллельны одной из кристаллографич. осей (осей координат). Если грань пересекает отрицат. направление оси, то над индексом ставится знак минус, напр. (121). Периоды ячеек а, b, с и углы между ребрами a, b, у измеряют рентгенографически.
Симметрия К. При нек-рых геом. преобразованиях gi К. способен совмещаться с самим собой, оставаясь инвариантным (неизменным). На рис. 3, а изображен К. кварца. Внеш. его форма такова, что поворотом на 120° вокруг оси 3 он м. б. совмещен сам с собой (совместимое равенство). К. Na2SiO3 (рис. 3,6) преобразуется сам в себя отражением в плоскости симметрии т (зеркальное равенство). Преобразования (операции) симметрии любого К. gi - повороты, отражения, параллельные переносы или комбинации этих преобразований -составляют мат. группы G(g0, g1,..., gn-1). Число п операций, образующих группу G, наз. порядком группы. Группы преобразований К. обозначают G3m, где m - число измерений, в к-ром объект периодичен, верх.
индекс 3 означает три измерения пространства, в. к-рых эти группы определены. Кристаллич. многогранник макроскопически непериодичен, группы симметрии таких многогранников (точечные группы) обозначают G30. Микроструктура К. на атомном уровне - трехмерно-периодическая, т.е.
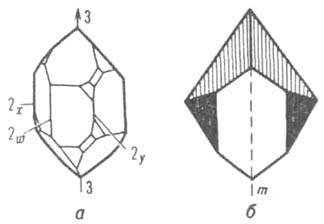
Рис. 3. Примеры кристаллов разной симметрии: а кристалл кварца (3 - ось симметрии 3-го порядка; 2x, 2y, 2w - оси 2-го порядка); б - кристалл водного Na2SiO, (m - плоскость симметрии).
описывается как кристаллич. решетка, соответствующие группы симметрии G33. После преобразования симметрии части объекта, находившиеся в одном месте, совпадают с частями, находящимися в др. месте. Это означает, что симметричный объект состоит из равных - совместимо и (или) зеркально - частей.
Симметрия К. проявляется не только в их структуре и св-вах в реальном трехмерном пространстве, но также и при описании энергетич. спектра электронов кристалла, при анализе дифракции рентгеновских лучей и электронов в кристаллах в обратном пространстве и т.п.
Пример К., к-рому присущи неск. операций симметрии, -К. кварца; он совмещается сам с собой при поворотах вокруг оси 3 на 120° (операция g1), на 240° (операция g2), а также при поворотах на 180° вокруг осей 2x, 2y, 2w (операции g3, g4, g5). Каждой операции симметрии м. б. сопоставлен элемент симметрии - прямая, плоскость или точка, относительно к-рой производится данная операция. Напр., оси 3, 2x, 2y, 2w - ocи симметрии, плоскость m - плоскость зеркальной симметрии и т.п. Последоват. проведение двух операций симметрии также является операцией симметрии. Всегда существует операция идентичности (отождествление) g0=1, ничего не изменяющая в К., геометрически соответствующая неподвижности объекта или повороту его на 360° вокруг любой оси.
Точечные группы симметрии. Операции точечной симметрии К.- повороты вокруг оси симметрии порядка N
на угол, равный 360o/N (рис. 4, а), отражение в плоскости симметрии т (зеркальное отражение; рис. 4,6), инверсия I (симметрия относительно точки; рис. 4, в) инверсионные повороты N (комбинация поворота на угол 360°/N с одновременной инверсией; рис. 4, г). Геометрически возможные сочетания этих операций определяют ту или иную точечную группу симметрии. При преобразованиях точечной симметрии по крайней мере одна точка объекта остается неподвижной. В ней пересекаются
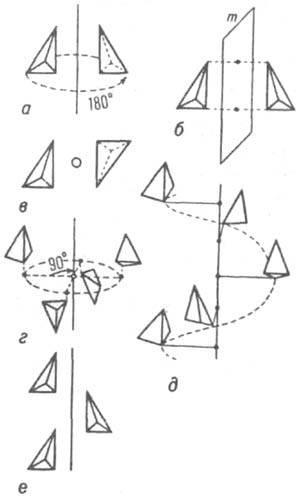
Рис. 4. Простейшие операции симметрии: а - поворот; б - отражение; в - инверсия; г - инверсионный поворот; д - винтовой поворот; е - скользящее отражение.
каются все элементы симметрии. Число точечных групп симметрии G03 бесконечно. Однако в К., ввиду наличия кристаллич. решетки, возможны только операции и соотв. оси симметрии до 6-го порядка, кроме 5-го (в кристаллич.

Примечание. Точечные группы симметрия чаще моего в лит. обозначают их международными символами.
решетке такая ось невозможна), к-рые обозначаются символами 1, 2, 3, 4. 6, а также инверсионные оси  (она же центр симметрии), 2 (она же плоскость симметрии т), 3, 5, 6. Поэтому число точечных групп симметрии К., иначе наз. кристаллографи ч. классами К., ограниченно, их всего 32 (см. табл.). В международные обозначения точечных групп входят символы порождающих их операций симметрии. Эти группы объединяются по симметрии формы элементарной ячейки в 7 сингоний - триклинную, моноклинную, ромбическую, тетрагональную, тригональную, гексагональную, кубическую.
(она же центр симметрии), 2 (она же плоскость симметрии т), 3, 5, 6. Поэтому число точечных групп симметрии К., иначе наз. кристаллографи ч. классами К., ограниченно, их всего 32 (см. табл.). В международные обозначения точечных групп входят символы порождающих их операций симметрии. Эти группы объединяются по симметрии формы элементарной ячейки в 7 сингоний - триклинную, моноклинную, ромбическую, тетрагональную, тригональную, гексагональную, кубическую.
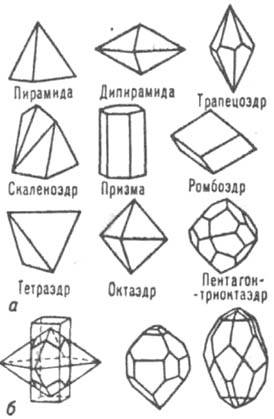
Рис. 5. Простые формы (а) кристаллов и нек-рые их комбинации (б).
Совокупность кристаллографически одинаковых граней (т. е. совмещающихся друг с другом при операциях симметрии данной группы) образует т. наз. простую форму К. Всего существует 47 простых форм К., но в каждом классе могут реализоваться лишь нек-рые из них. К. может быть огранен гранями одной простой формы (рис. 5, а), но чаще комбинацией этих форм (рис. 5,5). Огранка каждого К. подчиняется описывающей его точечной группе симметрии при равномерном развитии кристаллич. многогранника, когда он имеет идеальную форму (рис. 6). Группы, содержащие лишь повороты, описывают К., состоящие только из совместимо равных частей (группы 1-го рода; примеры таких операций даны на рис 4, a, д). Группы, содержащие отражения или инверсионные повороты, описывают К., в к-рых есть зеркально равные части (группы 2-го рода; примеры на рис. 4,6, г, е). К., описываемые группами 1-го рода, напр. кварца, винной к-ты, могут кристаллизоваться в двух энантиоморфиых формах (правой и левой), каждая из к-рых не содержит элементов симметрии 2-го рода (см. Энантиоморфизм).
Мн. св-ва К., принадлежащих к определенным точечным группам симметрии, описываются т. наз. предельными точечными группами, содержащими оси симметрии бесконечного порядка :. Наличие оси : означает, что
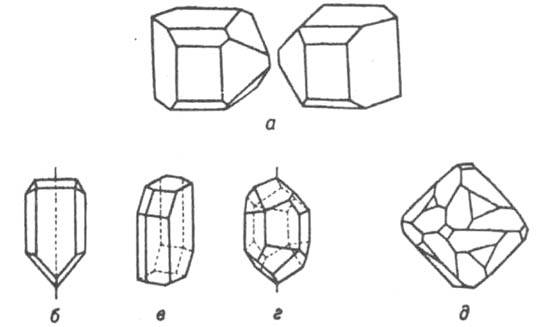
Рис. 6. Примеры огранки кристаллов, принадлежащих к разным точечным группам симметрии (классам): a - класс 2 (одна ось симметрии 2-го порядка, левая и правая формы); б - класс m (одла плоскость симметрии); в - класс  (центр симметрии); г - класс 6 (одна инверсионная ось 6-го порядка); д - класс 432 (оси 4-го, 3-го и 2-го порядков).
(центр симметрии); г - класс 6 (одна инверсионная ось 6-го порядка); д - класс 432 (оси 4-го, 3-го и 2-го порядков).
объект совмещается сам с собой при повороте на любой, в т. ч. бесконечно малый, угол (изотропные твердые тела, текстуры). Таких групп 7 (рис. 7). Т. обр., всего имеется 39 точечных групп, описывающих симметрию св-в К.
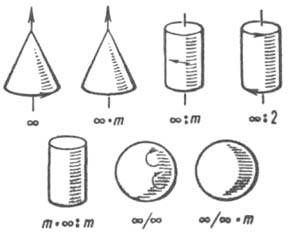
Рис. 7. Фигуры, иллюстрирующие предельные группы симметрии.
Симметрия структуры К. (расположения атомов и молекул, электронной плотности) описывается пространств. группами симметрии (наз. также федоровскими в честь нашедшего их Е. С. Федорова). Характерные для решетки операции - три некомпланарных переноса а, b, с- наз. трансляциями, они задают трехмерную периодичность атомной структуры К. Перенос структуры на векторы a, b, с или любой вектор t=pla+р2b+p3с, где р1, p2, p3 - любые целые положит, или отрицат. числа, совмещает структуру К. с собой и, следовательно, является операцией (трансляционной) симметрии. Совокупность трансляций представляет собой группу переносов Т3, к-рая является подгруппой T3 М G33 каждой федоровской группы (т.е. содержит часть операций G33 - только трансляции); таких групп, наз. также типами решеток Браве, 14 (рис. 8). Они имеют элементарную ячейку, соответствующую данной сингонии, но могут отличаться центрированностью части или всех граней или объемом ячейки. Вследствие возможности комбинирования в решетке трансляций и операций точечной симметрии в федоровских группах G33 возникают операции и соответствующие им элементы симметрии с трансляц. компонентой - винтовые оси разл. порядков и плоскости скользящего отражения (рис. 4, г-е). Всего известно 230 пространств. групп симметрии С33.
Трансляц. компоненты элементов микросимметрии макроскопически не проявляются, напр. винтовая ось в огранке К. проявляется как соответствующая простая поворотная ось. Поэтому каждая из 230 групп С33 макроскопически сходственна (гомоморфна) с одной из 32 точечных групп G30. Напр., на точечную группу ттт гомоморфно отображается 28 пространств. групп: Рттт, Рппп, Рccт, Рbап и т.д. Атомное строение К. Методы структурного анализа позволяют определить конкретную кристаллич. структуру любого в-ва (расположение атомов в элементарной ячейке, расстояния между ними, параметры тепловых колебаний
атомов К. и т.д.). Примеры нек-рых атомных структур К. даны на рис. 9.
Кристаллич. структуры классифицируют по их хим. составу, в осн. определяющему тип хим. связи, по взаимной
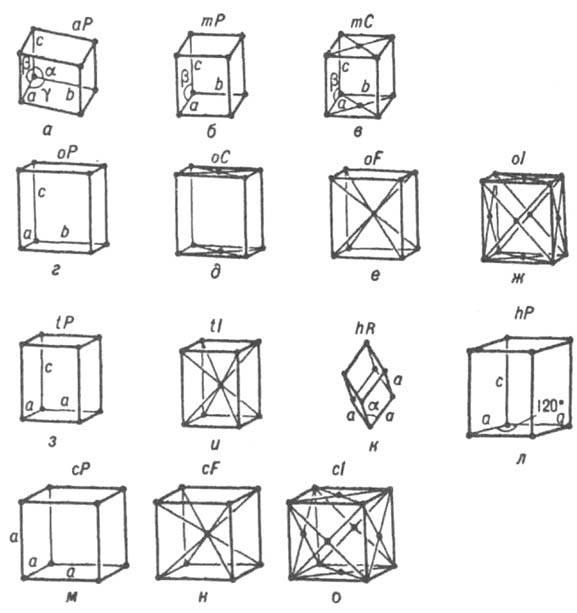
Рис. 8. Четырнадцать решеток Брам: а - триклинная; б, в - моноклинные; г-ж - ромбические; з, и - тетрагональные; к - тригональная (ромбоэдрич.); л - гексагональная; м-о - кубические. Тип решетки: а, 6, г, з, к, м - примитивный. в, д, л - базоцентрированный. е, и, н - объемноцентрированиый, ж, о - гранецентрированный.
координации атомов (слоистые, цепные, каркасные, координац. структуры). При изменении т-ры или давления структура К. может изменяться. Существование у данного в-ва неск. кристаллич. модификаций (фаз) наз. полиморфизмом. Нск-рые кристаллич. структуры метастабильны, напр. алмаз, к-рый не переходит в графит при обычных условиях. В то же время разные соед. могут иметь одинаковую кристаллич. структуру (см. Изоморфизм).
Распределение К. по пространств. группам симметрии - по точечным группам (классам) и сингониям - неравномерно. Как правило, чем проще хим. ф-ла в-ва, тем выше симметрия его К. Так, почти все металлы имеют кубич. или гексаген, структуру, основанную на т. наз. плотной упаковке атомов. Усложнение хим. ф-лы в-ва ведет к понижению симметрии его К. и увеличению размеров элементарных ячеек. Молекулярные кристаллы почти всегда относятся к низшим сингониям.
Тип хим. связи между атомами в К. определяет мн. их св-ва. Ковалентные кристаллы имеют высокую твердость, малую электрич. проводимость, большие показатели преломления. Металлические кристаллы хорошо проводят электрич. ток и тепло, пластичны, непрозрачны. Мол. К. легкоплавки. Более низкую атомную упорядоченность, чем К., имеют жидкие кристаллы, в-ва в аморфном состоянии, недавно открытые квазикристаллы, полимеры, жидкости.
Совр. методы позволяют исследовать не только геом. атомную структуру К., но также магн. структуру или электрич. дипольную. Напр., распределение ядер и электронов в ферромагнитном К. можно описать с помощью обычной пространств. симметрии, но если учесть распределение в нем магн. моментов (рис. 9, г), то обычной классич. симметрии уже недостаточно. В этом случае используют понятия антисимметрии и цветной симметрии. Такую антисимметрию можно истолковать так: при применении
преобразования симметрии часть фигуры м. б. не только равна себе, но и "антиравна", что можно условно описать как изменение знака или цвета - черный на белый (рис. 10). Существует 58 групп точечной антисимметрии C3,а0 и 1651
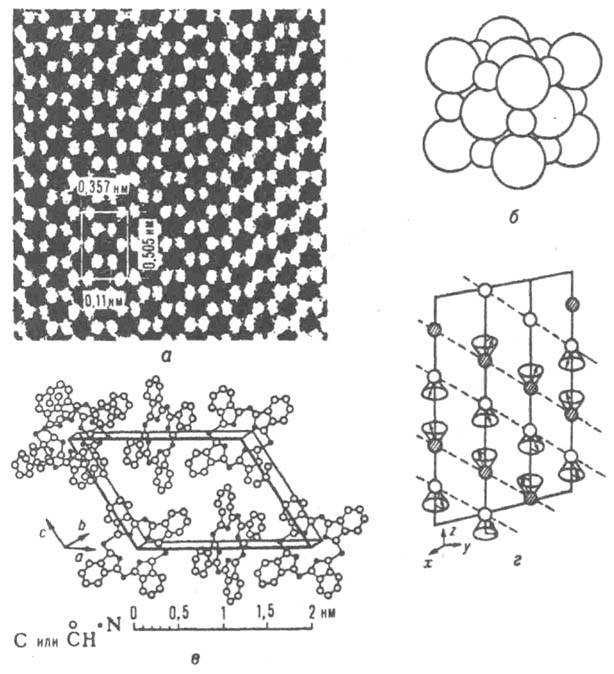
Рис. 9. Примеры атомных структур: а - алмаз [электронная микрофотография высокого разрешения, расположение атомов в проекции на плоскость (110)]; б NaСl (изображение структуры в соприкасающихся шарах); в - фталоцианин (расположение молекул в элементарной ячейке); г - ферри магнитны и кристалл [распределение магн. моментов (показаны стрелками) атомов в элементарной ячейке, описываемое с помощью обобщенной симметрии.
пространств. групп антисимметрии G3,а0 (шубниковские группы). Если добавочная переменная приобретает не два значения, а несколько (возможны числа 3, 4, 6, 8, ..., 48), то возникает цветная симметрия Белова. Так, известна 81 точечная группа G3,и0 и 2942 группы С3,и3. Развит и аппарат симметрии в пространстве 4, 5 измерений, позволяющий описывать сверхпериодичные, т. наз. соразмерные и несоразмерные структуры сегнетоэлектриков, магн. и иных структур.

Рис. 10. Фигура, описываемая точечной группой антисимметрии.
Строение реальных К. Неравновесные условия кристаллизации приводят к разл. отклонениям формы К. от плоских граней - к округлым граням и ребрам (вициналям), возникновению пластинчатых, игольчатых, нитевидных (см. Нитевидные кристаллы), ветвистых (дендритных), К. типа снежинок. Если в объеме расплава образуется сразу большое число центров кристаллизации, то разрастающиеся К., встречаясь друг с другом, приобретают форму неправильных зерен. Нередко возникают микроскопии, двойники и др. сростки. При выращивании К. не стремятся обязательно получить их в правильной кристаллографич. огранке, главный критерий качества - однородность и совершенство
атомной структуры, отсутствие ее дефектов. Нек-рым К. при выращивании придается форма требуемого изделия - трубы, стержня, пластинки.
Вследствие нарушения равновесных условий роста и захвата примесей при кристаллизации, а также под влиянием разл. рода внеш. воздействий идеальная трехмерно-периодич. атомная структура К. всегда имеет те или иные нарушения. К ним относят точечные дефекты - вакансии, замещения атомов осн. решетки атомами примесей, внедрение в решетку инородных атомов, дислокации и др. (см. Дефекты в кристаллах). Введение небольшого числа атомов примеси, замещающих атомы осн. решетки, используют в технике для придания нужных физ. св-в К., как, напр., в случае легирования.
Захват атомов примесей гранями К. приводит к секториальному строению. Может происходить и периодич. изменение концентрации захватываемой примеси, что дает зонарную структуру. Кроме того, при росте К. почти неизбежно образуются макроскопич. дефекты - включения, напряженные области и т.д.
Большинство реальных К. имеют мозаичное строение: они разбиты на блоки мозаики - небольшие (~10-4см) области, в к-рых порядок почти идеален, но к-рые разориентированы по отношению друг к другу на малые углы (приблизительно неск. мин). В то же время удается получить нек-рые синтетич. К. высокой степени совершенства, напр. бездислокационные К. Si, Ge и др.
Изучение их составляет предмет Кристаллохимии.
Физические свойства К. Обусловлены атомно-кристаллич. структурой, ее симметрией, силами связи между атомами и энергетич. спектром электронов решетки, а нек-рые из св-в - дефектами идеальной структуры. Поляризуемость, преломление и поглощение света, электро- и магнитострикция, пьезоэлектричество и пьезомагнетизм, собственная проводимость математически описываются тензорами, ранг к-рых зависит от типа воздействия на К. и его отклика. При этом К. рассматривается как сплошная анизотропная среда. Анизотропию наглядно выражают пов-сти, описываемые ур-ниями с коэф. соответствующего тензора. Для К. данного класса можно указать симметрию его св-в. Симметрия физ. св-в в К. описывается группами точечной симметрии - одной из 32 кристаллографич. или 7 предельных (рис. 7). Так, в К. кубич. сингонии св-ва, выражаемые тензорами 2-го ранга (напр., прохождение света, тепловое расширение), изотропны и характеристич. пов-сти являются сферами (группа :/: или :/:.m), но эти К. обладают анизотропией в отношении упругих, электрооптич., пьезоэлектрич. св-в. С понижением симметрии К., как правило, возрастает анизотропия их св-в. В нек-рых К. ионы, образующие решетку, располагаются так, что К. оказывается самопроизвольно (спонтанно) электрически поляризованным (пироэлектрики). Пироэлектричество возможно в 10 классах, имеющих одну ось симметрии или плоскость симметрии. Пьезоэлектричество возможно в К. 20 классов без центра симметрии. Проводимость и др. электронные св-ва К. связаны с квантовомех. характером движения в них своб. электронов, к-рые вследствие дифракции на кристаллич. решетке в нек-рых направлениях распространяться не могут, возникает т. наз. запрещенная зона. К. с полностью заполненными зонами валентных электронов - диэлектрики. В металлах электронов в зоне проводимости много, они хорошо проводят электрич. ток.
Ряд св-в К. - прочность, пластичность, окраска, люминеcцентные св-ва и др. - зависят от кол-ва и типов дефектов в К. В бездислокационных К. (Ge, Si), а также в нитевидных прочность в 10-100 раз больше, чем в обычных К., и достигает теоретич. значений. Окраска мн. К. связана с наличием в них тех или иных примесных атомов.
Применение К. основано на св-вах или сочетании св-в многих из них, напр. высокой твердости и прозрачности (алмаз), а также на способности откликаться на внеш. воздействия, в частности преобразовывать одно физ. поле в другое. Пьезо- (кварц и др.) и сегнетоэлектрич. К. (напр.,
BiTiO3) применяют в радиотехнике, К. с полупроводниковыми св-вами (Si, Ge и др.) - в электронике. К. галогенидов щелочных металлов, сапфира и др. используют как оптич. материалы. Исключит. значение имеют ионные К. для лазерной техники - рубин, иттрий-алюминиевый гранат и др., полупроводниковые лазерные кристаллы. В технике управления световыми пучками используют К., обладающие электрооптич. св-вами. Для удвоения частоты лазерного излучения применяют оптич. К. (КН2РО4 и др.), для измерения слабых изменений т-ры - пироэлектрич. К., для осуществления и измерения малых мех. и акустич. воздействий - К. пьезоэлектриков, пьезомагнетиков, пьезорезисторов и т. п. Высокие мех. св-ва сверхтвердых К. (алмаз) используют при обработке материалов и в бурении. К. корунда Аl2О3 применяют в оптич. лазерах, в ювелирном деле и др.
Лит.: Костов И., Кристаллография, пер. с болг., М., 1965; Бокий Г. Б., Кристаллохимия, 3 изд., М., 1971; Сиротин Ю. И., Шаскольская М. П., Основы кристаллофизики, 2 изд., М., 1979; Современная кристаллография, т. 1-4, М., 1979-81; Шафрановский И. И., Симметрия в природе, 2 изд.. Л., 1985. Б. К. Вайнштейн.

