Хроматы
X. щелочных металлов и Mg хорошо раств. в воде, у X. щел.-зем. металлов р-римость сильно уменьшается от Са к Ва. Р-ры X. имеют щелочную р-цию, X. тяжелых металлов в воде большей частью практически не раств., в особенности соли Pb, Bi, Ag, Hg. X. РЗЭ плохо раств., причем соед. элементов иттриевой группы водой разлагаются с образованием основных солей. X. щелочных и щел.-зем. металлов плавятся без разложения, X. остальных металлов большей частью разлагаются до плавления.
При подкислении р-ров X. образуются дихроматы (бихроматы), что сопровождается переходом их окраски в оранжевую. Дихромат-анион Cr2O72-построен из двух хромкислородных тетраэдров с общей вершиной по атому кислорода. Дихроматы щелочных, щел.-зем. и большинства тяжелых металлов легко раств. в воде. Трудно растворимы дихроматы Ag, Т1. Р-ры дихроматов имеют кислую р-цию. Дихроматы менее термически устойчивы по сравнению с X.(VI). Дихроматы - реагенты в дихроматометрии.
Для щелочных (кроме Li) и нек-рых др. металлов известны темно-красные трихроматы М2Сr3О10 и коричнево-красные тетрахроматы М2Сr4О13. Для мн. металлов получены оксохроматы и гидроксохроматы (основные X.). Оксо- и гидроксохроматы тяжелых металлов в воде не раств. Описано большое число двойных хроматов, напр. KZn2(CrO4)2OH х Н2О (используются как пигменты), хромато-сульфатов и т.д. Для нек-рых металлов известны хромато-дихроматы, напр. Bi2(CrO4)2Cr2O7. См. также Калия дихромат, Натрия хромат.
При действии Н2О2 на водные р-ры X. в зависимости от условий можно получить пероксохроматы: синие - состава
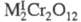 (получают из кислых р-ров) либо красные - состава
(получают из кислых р-ров) либо красные - состава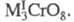 Синие пероксохроматы очень неустойчивы; при ударе, нагревании или соприкосновении
с конц. H2SO4 они взрываются. Красные пероксохроматы
разлагаются при нагр., при обычных т-рах довольно устойчивы.
Синие пероксохроматы очень неустойчивы; при ударе, нагревании или соприкосновении
с конц. H2SO4 они взрываются. Красные пероксохроматы
разлагаются при нагр., при обычных т-рах довольно устойчивы.
X.(VI) калия К2СrО4 - лимонно-желтые кристаллы; при 668 °С ромбич. форма переходит в гексагон. красную,
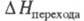 10,0 кДж/моль; т. пл. 973 °С,
10,0 кДж/моль; т. пл. 973 °С,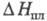 33,0 кДж/моль; р-римость в воде 38,96% по массе при 20 °С; не раств. в
этаноле, эфире; получают взаимод. К2Сr2О7
и К2СО3 в водном р-ре; в природе минерал тарапакоит;
протрава при крашении, дубитель в кожевенной пром-сти, отбеливатель для
масел, воска, протрава для семян, окислитель в орг. синтезе, реагент в
хроматометрии.
33,0 кДж/моль; р-римость в воде 38,96% по массе при 20 °С; не раств. в
этаноле, эфире; получают взаимод. К2Сr2О7
и К2СО3 в водном р-ре; в природе минерал тарапакоит;
протрава при крашении, дубитель в кожевенной пром-сти, отбеливатель для
масел, воска, протрава для семян, окислитель в орг. синтезе, реагент в
хроматометрии.
X.(VI) аммония (NH4)2CrO4 - золотисто-желтые кристаллы, р-римость в воде 27,2% по массе при 25 °С, мало раств. в этаноле и в ацетоне; т. разл. 180 °С; при хранении на воздухе постепенно теряет NH3 и превращается в дихромат; получают взаимод. р-ров NH3 с СrО3 или (NH4)2Cr2O7; протрава при крашении тканей, дубящее в-во, компонент светочувствит. слоя фотоматериалов. Дихромат аммония (NH4)2Cr2O7 - оранжево-красные кристаллы; разлагается выше 170 °С, при 240 °С - со вспышкой; р-римость в воде 29,18% по массе при 25 °С, раств. в этаноле, не раств. в ацетоне; получают взаимод. NH4C1 с Na2Cr2O7 в водном р-ре; окислитель в орг. синтезе, отбеливатель для жиров, воска, парафина, компонент светочувствит. слоя фотоматериалов, исходное в-во для синтеза оксидов Сr, катализаторов, получения фоторезисторов, фотосенсибилизаторов, компонент пиротехн. составов, консервант для древесины.
X.(VI) кальция СаСrО4 - желтые кристаллы; при 50 °С становится красно-коричневым (при охлаждении окраска восстанавливается); т. пл. ~ 1150 °С (под давлением О2), при атм. давлении т. пл. 1022 °С (с разл.); р-римость в воде 2,27% при 19 °С, 0,79% при 70 °С; из р-ров кристаллизуются ди-, моно- и гемигидраты, обладающие существенно большей р-римостью и полностью обезвоживающиеся при ~ 400 °С; раств. в этаноле; получают взаимод. р-ров Na2Cr2O7 с Са(ОН)2, либо Na2CrO4 с СаС12 с послед. прокаливанием осадка; в природе минерал хроматит; компонент шихты при алюмотермич. получении Сr, пигмент, ингибитор коррозии, компонент покрытий для легких сплавов, деполяризатор для батарей, окислитель при получении Сr.
X.(VI) бария ВаСrO4 - желтые кристаллы; т. пл. 1380 °С; практически не раств. в воде и орг. р-рителях, разлагается к-тами; получают взаимод. ВаС12 с К2Сr2О7; окислитель при синтезе красителей, компонент ВВ, пиротехн. составов, антикоррозионных покрытий на стали, составов головок спичек, пигмент (баритовый желтый) для керамики. X.(VI) цинка ZnCrO4 - лимонно-желтые кристаллы; разлагается выше 440 °С; практически не раств. в воде; образует гидраты с 7, 2 и 1 молекулами воды; при кипячении с большим кол-вом воды гидролизуется с образованием гидроксохроматов; получают взаимод. Zn(OH)2 с К2Сr2О7; пигмент, компонент антикоррозионных покрытий.
X.(VI) свинца РbСrO4 - желтые или оранжево-красные кристаллы; при 707 °С превращается в желтую ромбическую, а при 783 °С - в красную тетрагон. модификации; т. пл. 844 °С (с разл.); практически не раств. в воде и орг. р-рителях; раств. в HNO3, конц. р-рах щелочей; получают взаимод. р-ров нитрата или ацетата Рb с хроматами Na, К или NH+4; пигмент (желтый крон), окислитель в орг. синтезе, компонент материалов термохромных датчиков. Оксохромат свинца
Табл. 1.- СВОЙСТВА НЕКОТОРЫХ XPOMATOB(VI)
|
Соединение
|
Сингония
|
Параметры кристаллич.
решетки
|
z
|
Пространств. группа
|
Плотн., г/см3
|
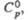
Дж/(моль x К) |
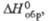
кДж/моль |
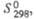
Дж/(моль x К) |
||||
|
а, нм
|
b,
нм
|
с, нм
|
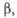 град
град |
|||||||||
|
К2СrO4
|
Ромбич.
|
0,593
|
1,042
|
0,763
|
—
|
4
|
Ртсп
|
2,73
|
146
|
-1408
|
200
|
|
|
(МН4)2СrO4
|
Моноклинная
|
0,615
|
0,630
|
0,776
|
115,22
|
—
|
—
|
1,89
|
-1163
|
657
|
||
|
(NH4)2CrO7
|
Моноклинная
|
0,774
|
0,754
|
1,326
|
93,70
|
2
|
С2/с
|
2,15
|
293
|
-1810
|
—
|
|
|
СuСrO4
|
Ромбич.
|
0,5433
|
0,8968
|
0,5990
|
—
|
4
|
Стcm
|
4,04
|
—
|
—
|
—
|
|
|
Ag2CrO4
|
Ромбич.
|
1,0063
|
0,7029
|
0,5540
|
—
|
4
|
Рпта
|
5,62
|
142
|
-732
|
218
|
|
|
СаСrO4
|
Тетрагон.
|
0,725
|
—
|
0,634
|
—
|
4
|
I4/amd
|
3,12
|
113
|
—
|
131
|
|
|
SrCrO4
|
Моноклинная
|
0,6794
|
0,7131
|
0,6489
|
102,90
|
—
|
—
|
3,895
|
—
|
—
|
—
|
|
|
ВаСrO4
|
Ромбич.
|
0,9105
|
0,5541
|
0,7343
|
—
|
4
|
Рпта
|
4,50
|
—
|
-1429
|
172
|
|
|
ZnCrO4
|
Ромбич.
|
0,5505
|
0,8383
|
0,6219
|
—
|
4
|
Стcm
|
3,40
|
—
|
—
|
—
|
|
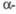 РbСrO4
РbСrO4 |
Моноклинная
|
0,710
|
0,740
|
0,680
|
77,50
|
4
|
Р21/с2
|
6,12
|
—
|
-925
|
167
|
|
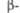 PbCrO4 PbCrO4 |
Ромбич.
|
0,867
|
0,559
|
0,713
|
—
|
4
|
Рпта
|
—
|
—
|
—
|
—
|
|
|
Pb2CrO4
|
Моноклинная
|
1,4018
|
0,5683
|
0,7143
|
115,23
|
4
|
C2/m
|
6,27
|
—
|
—
|
—
|
|
|
CoCrO4
|
Ромбич.
|
0,5516
|
0,8336
|
0,6262
|
—
|
4
|
Стст
|
4,08
|
—
|
—
|
—
|
|
Табл. 2.- СВОЙСТВА НЕКОТОРЫХ ХРОМАТОВ(III)
|
Соединение
|
Сингония
|
Параметры кристаллит,
решетки, нм
|
z
|
Пространств. группа
|
Т. пл., °С
|
Плотя., г/см3
|
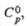
ДжДмоль x К) |
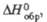
кДж/моль |
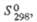
Дж/(моль x К) |
|||
|
а
|
b
|
с
|
||||||||||
|
NaCrO2
|
Тригон.
|
0,297
|
_
|
1,594
|
3
|
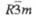 |
_
|
4,39
|
_
|
_
|
_
|
|
|
CuCrO2
|
Тригон.
|
0,2975
|
—
|
1,7096
|
3
|
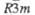 |
—
|
5,49
|
—
|
-674
|
—
|
|
|
CuCr2O4
|
Тетрагон.
|
0,8532
|
—
|
0,7788
|
—
|
I4/amd
|
—
|
—
|
—
|
-1288
|
—
|
|
|
MgCr2O4
|
Кубич.
|
0,8329
|
—
|
—
|
8
|
Fd3m
|
2350
|
4,43
|
127
|
-1787
|
106
|
|
|
CaCr2O4
|
Ромбич.
|
0,903
|
1,058
|
0,296
|
—
|
—
|
2170
|
4,98
|
—
|
-1841
|
—
|
|
|
ZnCr2O4
|
Кубич.
|
0,8337
|
—
|
—
|
8
|
Fd3m
|
—
|
5,29
|
—
|
-1550
|
—
|
|
|
CdCr2O4
|
Кубич.
|
0,8584
|
—
|
—
|
8
|
То же
|
—
|
5,79
|
—
|
-1438
|
—
|
|
|
MnCr2O4
|
Кубич.
|
0,8437
|
—
|
—
|
8
|
"
|
—
|
4,97
|
—
|
—
|
—
|
|
|
FeCr2O4
|
Кубич.
|
0,8420
|
—
|
—
|
8
|
"
|
2153
|
5,1
|
—
|
-1452
|
146
|
|
|
CoCr2O4
|
Кубич.
|
0,8342
|
—
|
—
|
8
|
"
|
—
|
5,14
|
—
|
-1430
|
138
|
|
|
NiCr2O4
|
Кубич.
|
0,8316
|
—
|
—
|
8
|
"
|
—
|
5,24
|
—
|
-1382
|
119
|
|
|
YCrO3
|
Ромбич.
|
0,5242
|
0,5520
|
0,7534
|
6
|
Рbпт
|
2430
|
5,76
|
97
|
-1555
|
97
|
|
|
LaCiO3
|
Ромбич.
|
0,5514
|
0,5478
|
0,7752
|
6
|
То же
|
2510
|
6,75
|
109
|
—
|
112
|
|
|
CeCrO3
|
Ромбич.
|
0,5475
|
0,5475
|
0,7740
|
6
|
"
|
2300
|
6,84
|
118
|
-1352
|
119
|
|
|
SmCrO3
|
Ромбич.
|
0,5367
|
0,5508
|
0,7643
|
6
|
"
|
2400
|
7,28
|
106
|
—
|
—
|
|
Pb2CrO5 - оранжевые или красные кристаллы, пигмент (оранжевый крон), материал для термисторов.
Хроматы(V) (иногда их наз. хроманатами)
- большей частью черного, голубовато-черного или темно-зеленого цвета,
содержат тетраэдрич. анион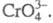 Для щелочных металлов получены соед. типа М3СrО4
и МСr3О8, для щел.-зем.-типа М3(СrО4)2,
М2Сr2О7 и М5(СrО4)3ОН,
для РЗЭ - типа МСrО4. Получают X.(V) термич. разложением X.(VI)
в смеси с оксидом или нитратом соответствующего металла, гидротермальным
путем, взаимод. оксидов при высоких давлениях и т. д. Мало раств. в воде,
при кипячении с водой гидролизуются с диспропорционированием на Сr(III)
и Cr(VI).
Для щелочных металлов получены соед. типа М3СrО4
и МСr3О8, для щел.-зем.-типа М3(СrО4)2,
М2Сr2О7 и М5(СrО4)3ОН,
для РЗЭ - типа МСrО4. Получают X.(V) термич. разложением X.(VI)
в смеси с оксидом или нитратом соответствующего металла, гидротермальным
путем, взаимод. оксидов при высоких давлениях и т. д. Мало раств. в воде,
при кипячении с водой гидролизуются с диспропорционированием на Сr(III)
и Cr(VI).
Хроматы(IV) большей частью представляют
собой сложные оксиды, хотя в структуре нек-рых из них имеется тетраэдрич.
анион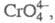 преим. зеленого цвета. Для щелочных металлов известны X. типа М2СrО3
и М4СrO4, для щел.-зем.- типа МСrО3, М2СrО4,
М3СrО5 и М4СeO6.
преим. зеленого цвета. Для щелочных металлов известны X. типа М2СrО3
и М4СrO4, для щел.-зем.- типа МСrО3, М2СrО4,
М3СrО5 и М4СeO6.
Хроматы(III) (устар. назв. хромиты) представляют
собой сложные оксиды (табл. 2). Х.(III) металлов в степени окисления +
1имеют
состав МСrО2 (метахромиты), получены также М3СrO3
(ортохромиты). Для металлов в степени окисления +2 характерны соед. МСr2О4
(многие из них имеют структуры типа шпинели). РЗЭ, кроме Sc, дают соед.
МСrО3
со структурами типа перовскита. Получают Х.(III) спеканием
Сr2О3 с оксидами, карбонатами и др. соед. металлов,
а также восстановлением или термич. разложением X.(VI) и дихро-матов(VI).
Из р-ров, получающихся в результате р-рения гидроксида Сr(III) в щелочи,
кристаллизуются гидроксохроматы(III) состава МСr(ОН)4, М3Сr(ОН)6
и даже М4Сr(ОН)7. Для щел.-зем. металлов получены
гидроксохроматы типа М3Сr2(ОН)2 со структурой
типа граната. Х.(III) в осн. тугоплавки, химически стойки.
Х.(III) магния MgCr2O4
- темно-зеленые, серо-зеленые или красные кристаллы; получают нагреванием
MgCr2O7 или спеканием MgO с Сr2О3
с добавкой В2О3; в природе минерал магнезиохромит;
компонент огнеупоров, катализатор орг. синтеза. Х.(III) цинка ZnCr2O4
- светло-зеленые кристаллы; получают прокаливанием смеси нитратов Zn и
Сr или термич. разложением ZnCr2O7; катализатор орг.
синтеза, компонент керамич. датчиков влажности. Х.(III) желез а(II) FeCr2O4
- черные или темно-коричневые кристаллы; получают нагреванием смеси FeCl3
+ К2Сr2О7 или Fe2O3 + Сr2О3
с добавкой Н3ВО3; в природе минерал хромит; компонент
огнеупоров, катализатор орг. синтеза; природный - сырье для извлечения
Сr. См. также Лантана хромат.
Известны X., содержащие Сr в двух степенях
окисления, в частности +3 и +4 (напр., Sr4Cr2O9),
+4 и +6 [Са5(СrО4)3] или +5 и +6 [Са10(СrО4)7].
Иногда их наз. хромито-хроматами, а состав выражают ф-лой mMO x
nCrO3
xpCr2O3.
X. и дихроматы Na, К и аммония обладают
местным и общим токсич. действием. Их аэрозоли вызывают прободение хрящевой
части носовой перегородки, воспаление гортани и придатков носовой полости.
Могут вызвать тяжелые ожоги кожи, экзему, язвы. Поражают органы дыхания
и желудочно-кишечный тракт. Токсична пыль и нерастворимых X., нек-рые канцерогенны.
ПДК X. (в пересчете на СrО3) 0,01 мг/м3.
П. И. Федоров.

