Хрома сульфаты
ХРОМА СУЛЬФАТЫ. Сульфат хрома (III)
Cr2(SO4)3 -красновато-коричневые кристаллы
тригон. сингонии (а = 0,812 нм, с = 2,186 нм); плотн. 3,012 г/см3;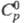 281 Дж/(молъ x К);
281 Дж/(молъ x К);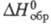 -3308
кДж/моль;
-3308
кДж/моль;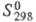 288 Дж/ (моль x К); выше 350 °С разлагается до Cr2O(SO4)2,
выше 640 °С - до Сr2О3. Не раств. в холодной воде
и разб. к-тах, плохо раств. в этаноле.
288 Дж/ (моль x К); выше 350 °С разлагается до Cr2O(SO4)2,
выше 640 °С - до Сr2О3. Не раств. в холодной воде
и разб. к-тах, плохо раств. в этаноле.
Кристаллогидрат Cr2(SO4)3
x 18Н2О - сине-фиолетовые кристаллы; т. пл. ~ 80 °С; плотн.
1,70 г/см3;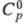 934
Дж/ (моль x К);
934
Дж/ (моль x К);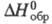 -8317 кДж/моль;
-8317 кДж/моль;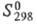 1035 Дж/(моль x К); р-римость в воде (в пересчете на безводную соль) 45,4%
по массе при 20 °С, раств. в этаноле; при плавлении превращается в зеленый
декагидрат, при 100 °С переходит в пентагидрат, при 440 °С - в безводную
соль. Описаны также фиолетовые гидраты с 17, 16, 15 и 14 молекулами воды.
При нагр. фиолетовых водных р-ров до 70-80 °С они становятся зелеными,
после чего из них м. б. выделены зеленые гидраты, в к-рых часть анионов
1035 Дж/(моль x К); р-римость в воде (в пересчете на безводную соль) 45,4%
по массе при 20 °С, раств. в этаноле; при плавлении превращается в зеленый
декагидрат, при 100 °С переходит в пентагидрат, при 440 °С - в безводную
соль. Описаны также фиолетовые гидраты с 17, 16, 15 и 14 молекулами воды.
При нагр. фиолетовых водных р-ров до 70-80 °С они становятся зелеными,
после чего из них м. б. выделены зеленые гидраты, в к-рых часть анионов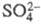 находится во внутр. сфере комплекса (см. Хром).
находится во внутр. сфере комплекса (см. Хром).
Известны зеленые кристаллогидраты с 15
молекулами воды (плотн. 1,867 г/см3), с 8, 6, 5 и 3 (плотн.
2,429 г/см3) молекулами воды и др. Стеклообразные или аморфные
гидраты хорошо раств. в воде, не раств. в этаноле.
Сульфат Сr(III) с сульфатами щелочных
металлов образует квасцы. Из конц. сернокислых р-ров выделены кислые
сульфаты Сr2(SО4)3 x Н2SО4
x
16Н2О (фиолетовый и зеленый) и др., к-рые иногда рассматривают
как хромсерные к-ты. Они хорошо раств. в воде.
Получают Cr2(SO4)3
взаимод. гидроксида Сr(III) или феррохрома с H2SO4,
зеленый сульфат - восстановлением СrО3 в сернокислом р-ре. Используют
как протраву при крашении, дубитель в кожевенной пром-сти, как пигмент
для лаков и красок, керамики, зеленых чернил.
В техн. лит. под названием X. с. часто
фигурирует смесь Cr(OH)SO4 с Na2SO4 или K2SO4
(может содержать др. гидроксосульфаты) - аморфный зеленый порошок, растворимый
в воде. Получают восстановлением сернокислых р-ров Na2Cr2O7
или К2Сr2О7 орг. в-вами (напр., формалином,
мелассой, древесными опилками) или SO2 при нагр. с послед. выпариванием
и высушиванием. Дубитель в кожевенной пром-сти.
Сульфат хрома(II) CrSO4
x 5Н2О
- синие кристаллы триклинной сингонии (а = 0,724, b= 1,094,
с = 601 нм,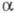 = 125,32°,
= 125,32°,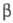 =
97,63°,
=
97,63°,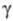 =
94,32°); в сухом состоянии устойчив на воздухе; раств. в воде (17,3% по
массе при О °С), р-ры очень легко окисляются О2 воздуха; обезвоживается
при 30-265 °С с последоват. образованием тетра-, ди- и моногидрата, безводный
разлагается при ~ 500 °С до Сr2О3. С сульфатами щелочных
металлов образует двойные соли типа шенита M2Cr(SO4)2
x
6H2O. Получают растворением Сr в H2SO4
или восстановлением р-ров Cr2(SO4)3 электролитически
или цинком. Используются (р-ры) в аналит. химии, как восстановитель в орг.
синтезе, как поглотитель О2 из газов.
=
94,32°); в сухом состоянии устойчив на воздухе; раств. в воде (17,3% по
массе при О °С), р-ры очень легко окисляются О2 воздуха; обезвоживается
при 30-265 °С с последоват. образованием тетра-, ди- и моногидрата, безводный
разлагается при ~ 500 °С до Сr2О3. С сульфатами щелочных
металлов образует двойные соли типа шенита M2Cr(SO4)2
x
6H2O. Получают растворением Сr в H2SO4
или восстановлением р-ров Cr2(SO4)3 электролитически
или цинком. Используются (р-ры) в аналит. химии, как восстановитель в орг.
синтезе, как поглотитель О2 из газов.
П. И. Федоров.

