Хлор
ХЛОР (от греч. chloros - желто-зеленый;
лат. Chlorum) C1, хим. элемент VII гр. периодич. системы, относится к галогенам;
ат. н. 17, ат. м. 35,453. Прир. X. состоит из смеси двух изотопов 35С1
(75,77%) и 37С1 (24,23%); ядра обоих изотопов имеют электрич.
квадрупольный момент. Конфигурация внеш. электронной оболочки атома 3s23р5;
степени окисления -1 (хлориды), +1 (гипохлориты), +3 (хлориты),
+5
(хлораты)и +7 (перхлораты); сродство к электрону 3,614 эВ;
потенциал ионизации при последоват. переходе от С1° к С17+ 12,96776,
23,805, 39,90, 53,50, 67,80, 96,7 и 114,27 эВ; электроотрицательность по
Полингу 3,16; ковалентный радиус С1° 0,099 нм; ионные радиусы (в скобках
указаны координац. числа) Сl-0,167 нм (6), С15+ 0,026
нм (3), С17+ 0,022 нм (4), 0,041 нм (6).
Молекула X. двухатомна, длина связи (в
газе) r = 0,1987 нм. Имеет два связанных состояния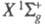 и
и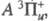 последнее
-возбужденное с энергией 2,2109 эВ и r = 0,2435 нм. Эти состояния
коррелируют с валентными состояниями атома хлора
последнее
-возбужденное с энергией 2,2109 эВ и r = 0,2435 нм. Эти состояния
коррелируют с валентными состояниями атома хлора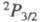 и
и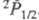 . Сродство
С12 к электрону 2,45 эВ, потенциал ионизации 11,48 эВ. Энергия
диссоциации С12 239,240 кДж/ моль, равновесная термич. диссоциация
С12 на атомы определяются константой К°(Т) =р2(Сl)/р(Сl2),
где
р - давление; lgК° = -6,8257 (1000 К), 0,2660 (2000 К), 1,9617
(3000 К).
. Сродство
С12 к электрону 2,45 эВ, потенциал ионизации 11,48 эВ. Энергия
диссоциации С12 239,240 кДж/ моль, равновесная термич. диссоциация
С12 на атомы определяются константой К°(Т) =р2(Сl)/р(Сl2),
где
р - давление; lgК° = -6,8257 (1000 К), 0,2660 (2000 К), 1,9617
(3000 К).
Среднее содержание X. в земной коре 1,7
x 10-2% по массе. Очень велики запасы X. в мировом океане (среднее
содержание 18,83 г/л); в виде NaCl (50-240 г/л) находится в подземных рассолах.
В земной коре X. встречается в осн. в виде каменной соли (галита) NaCl,
карналлита KCl x MgCl2 x 6H2O, сильвина
КС1, сильвинита NaCl x KCl, каинита КС1 MgSO4 x3H2O,
бишофита MgCl2 x 6H2O, тахгидрита 2MgCl2
x CaCl2 x 12H2O; другие
менее распространенные минералы - кераргирит AgCl, бисмоцелит BiOCl, псевдокотуннит
К2РbС14, баумлерит 2КС1 xСаС12.
Содержание X. в силикатных (каменных) метеоритах 0,09%, в железных - 0,36%
(в осн. в виде FеС13), в вулканич. газах - до 1,3% (в виде С12,
НС1, NaCl и др.). Содержание X. в человеческом теле 0,25% (0,45% от сухой
массы); в плазме крови 0,32-0,37%, в растениях зависит от вида и от состава
почвы, напр., табак содержит 2,3% X., морковь - 1,5%, зерно - 0,05%, картофель
- 0,03%.
Свойства. X.- желто-зеленый газ
с резким удушающим запахом; т. пл. -100,98 °С, т. кип. -33,97 °С; тройная
точка: т-ра 172,17 К, давление 1,392 кПа, dp/dT= 0,128 кПа/К; tкрит143,75
°С, ркрит7977,3 кПа, dкрит 0,573 г/см3;
ур-ние температурной зависимости плотн. в интервале от -90 до 80 °С d=
1,6583346
- 0,002003753/(t + 80) + 0,0545596743 x (t+
80)2
г/см3, при 25 °С плотн. 3,214 г/см3, плотн.
твердого при -195 °С 2,13 г/см3; для С12: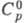 33,949 Дж/(моль x К),
33,949 Дж/(моль x К),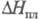 6,757 кДж/моль,
6,757 кДж/моль,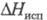 22,43 кДж/моль,
22,43 кДж/моль,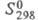 222,965 Дж/ (моль x К); для атома С1 (газ):
222,965 Дж/ (моль x К); для атома С1 (газ):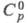 21,838 Дж/(моль x К),
21,838 Дж/(моль x К),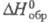 121,302 кДж/моль,
121,302 кДж/моль,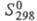 165,076 Дж/(моль x К); для иона Сl-(газ):
165,076 Дж/(моль x К); для иона Сl-(газ):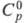 20,786 Дж/(моль x К),
20,786 Дж/(моль x К),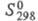 153,346 Дж/(моль x К),
153,346 Дж/(моль x К),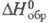 -233,670 кДж/моль,
-233,670 кДж/моль,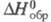 Сl- (в воде) -167,080 кДж/ моль; ур-ние температурной зависимости
давления пара lnp = A + B/T+ClnT+DT+E(F-T)/FT (205-417 К),
где А = 62,402508, В = -4343,5240, С = -7,8661534,
D
= = 1,0666308 x 10-2, E = 95,248723,
F = 424,90; при 20 °С давление пара С12 0,669 МПа;
Сl- (в воде) -167,080 кДж/ моль; ур-ние температурной зависимости
давления пара lnp = A + B/T+ClnT+DT+E(F-T)/FT (205-417 К),
где А = 62,402508, В = -4343,5240, С = -7,8661534,
D
= = 1,0666308 x 10-2, E = 95,248723,
F = 424,90; при 20 °С давление пара С12 0,669 МПа;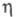 4,88
x 10-4 Па x с, ур-ние температурной зависимости
4,88
x 10-4 Па x с, ур-ние температурной зависимости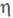 =
[0,00585(1 + 0,05878t - 0,05392t2)] х 10-5
Па x с (от -34 до -77 °С);
=
[0,00585(1 + 0,05878t - 0,05392t2)] х 10-5
Па x с (от -34 до -77 °С);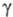 x
10-5 Н/см 31,61 (-61,3 °С), 28,38 (-44,5 °С), 25,23 (-28,7
°С), ур-ние температурной зависимости
x
10-5 Н/см 31,61 (-61,3 °С), 28,38 (-44,5 °С), 25,23 (-28,7
°С), ур-ние температурной зависимости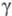 =
[21,70(1 - 0,007742t)] x 10-5 Н/см;
=
[21,70(1 - 0,007742t)] x 10-5 Н/см;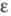 1,00152 (25 °С), 2,147 (-65,15 oC), 2,088 (-45,25 °С), 2,051
(-22,0 °С), 1,968 (0 °С), 1,54 (142 °С). Электродный потенциал С12
(газ, 0,1 МПа)/С1- (в воде коэф. активности ~ 1) 1,3583 В; изотермич.
коэф. сжимаемости жидкого X. в интервале 0-10 МПа 0,0118%/МПа, адиабатич.
коэф. сжимаемости газообразного X. 5,73 x 10-5%/мм
рт. ст.; температурный коэф. объемного расширения 21,9 x10-4
К-1 (298К); теплопроводность 0,079 Вт/(мx К) при
273 К. Кристаллизуется при -160 °С в ромбич. решетке, а = 0,624
нм, b = 0,448 нм, с = 0,826 нм, z = 4, пространств. группа
Cmca, r = 0,1980 нм.
1,00152 (25 °С), 2,147 (-65,15 oC), 2,088 (-45,25 °С), 2,051
(-22,0 °С), 1,968 (0 °С), 1,54 (142 °С). Электродный потенциал С12
(газ, 0,1 МПа)/С1- (в воде коэф. активности ~ 1) 1,3583 В; изотермич.
коэф. сжимаемости жидкого X. в интервале 0-10 МПа 0,0118%/МПа, адиабатич.
коэф. сжимаемости газообразного X. 5,73 x 10-5%/мм
рт. ст.; температурный коэф. объемного расширения 21,9 x10-4
К-1 (298К); теплопроводность 0,079 Вт/(мx К) при
273 К. Кристаллизуется при -160 °С в ромбич. решетке, а = 0,624
нм, b = 0,448 нм, с = 0,826 нм, z = 4, пространств. группа
Cmca, r = 0,1980 нм.
X. хорошо раств. в неполярных жидкостях,
хуже - в воде. Р-римость, % по массе: в СС14 - 16,4 (0 °С),
8,46 (25 °С), бензоле - 24,7 (10 °С), 18,5 (20 °С), 14,7 (30 °С), воде
- 1,44 (О °С), 1,07 (6 °С), 0,828 (15 oC), 0,711 (20 °С), 0,626
(25 °С), 0,449 (40 °С), 0,323 (60 °С). В конц. р-рах NaCl р-римость С12
в неск. раз ниже, чем в воде. В водном р-ре X. устанавливается равновесие:
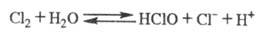
Из водного р-ра кристаллизуется клатрат
С12 x 6Н2О, давление его диссоциации 0,1
МПа при 9,6 °С. С ионом СГ молекулы С12 образуют в водном р-ре
ионы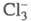 по р-ции:
по р-ции: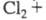 +
+ K
= 0,19. Жидкий X. сам может служить р-рителем, напр. р-римость в С12,
% по массе: ВС13 65,5 (-136,4 °С), SiCl4 28,8 (О
°С), Т1С14 74,9 (20 °С).
K
= 0,19. Жидкий X. сам может служить р-рителем, напр. р-римость в С12,
% по массе: ВС13 65,5 (-136,4 °С), SiCl4 28,8 (О
°С), Т1С14 74,9 (20 °С).
X. - один из наиб. химически активных
элементов, он непосредственно взаимод. со всеми металлами и большинством
неметаллов (образуя хлориды), лишь р-ция X. с О2, N2
и Хе требует спец. методов активации - УФ облучения или электроразряда,
в остальных случаях достаточно простого нагревания. Хлорирование наиб.
пассивных к X. металлов начинается при след. т-рах, °С: Ni 680, Mg 600,
Pt 560, W 540, Сг 520, Mo 420, Та 380, Ag 260, Ti 250, Си и А1 240, Fe
215. Сера и фтор реагируют с X. при комнатной т-ре, Si -при 200 °С, углерод
в виде графита устойчив к X. до 700 °С. Реакционная способность оксидов
металлов по отношению к X. (образуются хлориды) значительно ниже, чем у
соответствующих металлов, и убывает в ряду: Na2O, Ag2O,
CaO, PbO, CdO, MnO, NiO, ZnO, FeO, MgO, Fe2O3, ZnO2,
TiO2, A12O3,
SiO2. В присут. углерода т-ра
хлорирования оксидов снижается.
Причина высокой химической активности
X.- в сравнительной легкости образования атомов С1 из молекул С12,
в высоком сродстве атома X. к электрону (самое высокое среди атомов хим.
элементов; выше, чем у фтора) и в высокой энергии связи X. с большинством
элементов. Стабильные соед. X.- хлориды, гипохлориты, хлориты, хлораты,
перхлораты. Действит. заряд на атоме С1 во всех соед. этих классов по абс.
величине значительно ниже формального. Из-за высокого сродства атома С1
и хлоркислородных радикалов к электрону X. бывает анионом, входит в состав
аниона ( ,
,
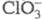 ,
, ) или является лигандом в комплексных анионах
) или является лигандом в комплексных анионах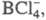
 и
т. п.
и
т. п.
Сильно экзотермич. р-ция X. с Н2
(С12 + Н2 2НС1)
приводит к образованию хлористого водорода (см. Соляная кислота), она
может протекать взрывообразно, особенно на свету: КПВ для системы Н2
- С12 11,5 - 95% по объему X. В присут. А1С13 р-ция
гладко протекает в темноте при 130 °С.
2НС1)
приводит к образованию хлористого водорода (см. Соляная кислота), она
может протекать взрывообразно, особенно на свету: КПВ для системы Н2
- С12 11,5 - 95% по объему X. В присут. А1С13 р-ция
гладко протекает в темноте при 130 °С.
Прямое взаимод. X. с N2 возможно
только в электроразряде, единств. известный бинарный хлорид азота NC13
чрезвычайно взрывчат, получают его хлорированием NH3 или солей
аммония (см. Азот). С кислородом X. образует неск. хлора оксидов,
наиб. важны С12О, С1О2, С12О6
и С12О7. Все оксиды X. нестабильны и взрывоопасны.
С фтором X. образует 3 бинарных фторида: C1F, C1F3 и C1F5,
все они м. б. получены прямой р-цией между элементами. Попытка выделить
высш. фторид X. не привела к успеху, однако известны его производные, напр.
кристаллич.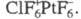 Прямой р-цией С12 с др. галогенами м. б. получены IC1, IС13
и BrCl. См. также Галогенфториды, Межгалогенные соединения. О взаимод.
X. с орг. в-вами см. Галогенирование.
Прямой р-цией С12 с др. галогенами м. б. получены IC1, IС13
и BrCl. См. также Галогенфториды, Межгалогенные соединения. О взаимод.
X. с орг. в-вами см. Галогенирование.
Получение. Практически весь производимый
в мире X. получают электрохим. методом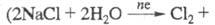
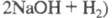 - электролизом водного р-ра NaCl или, гораздо реже, КС1. Другие продукты
электролиза - щелочь (1,13 т NaOH на 1 т С12) и Н2.
На получение 1 т X. расходуют в зависимости от способа произ-ва от 2300
до 3700 кВт x ч электроэнергии, что составляет примерно 50% издержек произ-ва
(в ценах на электроэнергию 1975), причем эта доля имеет тенденцию к росту.
На произ-во X. в США затрачивают ~2% всей вырабатываемой электроэнергии
и 28% энергии, потребляемой в электрохим. пром-сти.
- электролизом водного р-ра NaCl или, гораздо реже, КС1. Другие продукты
электролиза - щелочь (1,13 т NaOH на 1 т С12) и Н2.
На получение 1 т X. расходуют в зависимости от способа произ-ва от 2300
до 3700 кВт x ч электроэнергии, что составляет примерно 50% издержек произ-ва
(в ценах на электроэнергию 1975), причем эта доля имеет тенденцию к росту.
На произ-во X. в США затрачивают ~2% всей вырабатываемой электроэнергии
и 28% энергии, потребляемой в электрохим. пром-сти.
Используют 3 метода электролиза р-ров
хлоридов: 1) ртутный; катод - Hg, X. выделяется на твердом аноде и электродные
пространства не разделены; 2) диафрагменный; оба электрода твердые, анодное
и катодное пространство разделены фильтрующей диафрагмой; 3) мембранный;
анодное и катодное пространства разделены катионообменной мембраной. Первые
два метода существуют ок. 100 лет, третий применяют с 1975. При электролизе
по второму методу непосредственно в электролизере образуется р-р NaOH и
NaCl в молярном отношении 1:1. Упариванием этого "электролитич. щелока"
получают товарный NaOH, содержащий 2-3,5% (в пересчете на NaOH) NaCl. Электролизом
по первому способу получают амальгаму щелочного металла, при водном разложении
к-рой образуются конц. р-ры чистых щелочей NaOH или КОН. Возможность получения
чистых щелочей, отвечающих требованиям, предъявляемым к реактивам, была
осн. преимуществом ртутного метода до появления мембранного. Мембранный
метод позволяет получать чистые щелочи без использования Hg, экологически
менее опасен, требует меньшего расхода энергии и меньших капитальных вложений,
поэтому доля X., полученного этим методом, непрерывно возрастает. Одновременно
во всем мире падает доля ртутного метода. С 1986 Япония отказалась от ртутного
метода.
До 60-х гг. в качестве материала для анодов
в хлорном произ-ве использовался графит. Графитовые аноды подвергаются
быстрому разрушению при электролизе, поэтому они заменены на металлические
на основе Ti, Ti - Ru - Ir, Ti -Ir, Ti - Pt - Ir, покрытые активной массой
из оксидов Ti и Ru. Оксиднорутениевые аноды обладают очень высокой коррозионной
стойкостью (расход Ru ок. 0,1 г на 1 т С12) и обеспечивают хороший
выход X. по току даже при высокой степени превращения NaCl в анодном пространстве.
Фильтрующие диафрагмы изготовлялись из
асбестовой бумаги или волокна, ныне используют асбест с полимерными связующими,
что предупреждает набухание диафрагмы, либо полимерные диафрагмы из пористой
перфторир. пленки или волокна. Эти диафрагмы имеют срок службы более 500
сут.
Мембраны, непроницаемые для жидкости и
газа, пропускающие лишь ионы Na+ и К+, имеют толщину
0,1-0,25 мм и размеры 2 х 2 м, материал мембран - сополимеры тетрафторэтилена
с сульфонилированными или карбоксилированными перфторвиниловыми эфирами.
Срок службы мембран ок. 2 лет. В лаб. условиях X. получают действием р-ра
НС1 на пиролюзит МnО2.
Определение. Методы обнаружения и определения X. основаны на его окислит. св-вах. Для обнаружения X. в воздухе используют цветные р-ции - иод-крахмальную, желтое окрашивание флуоресцеина в щелочной среде. Для определения X. применяют иодометрич. метод, спектрофотометрич. методы - с о-толидином, с диметил- и диэтил-n-фенилендиаминами, с метиловым оранжевым и др. Потенциометрич. методы определения X. основаны на количеств. переводе его либо в Сl-, либо в СlO- с послед. титрованием. В газовом потоке X. может быть определен кулонометрически на газоанализаторе "Атмосфера-2". Атомно-абсорбционный, рентгеноспектральный и активационный метод используют в осн. для определения X. в виде хлорида.
Применение. X. расходуется на произ-во
окислительно-отбеливающих в-в - кальция гипохлорита, натрия гипохлорита,
LiClO, хлорной извести, а также хлоридов мн. элементов, разл.
хлорорг. продуктов (поливинилхлорида, хлоропренового каучука, р-рителей,
продуктов хлорирования углеводородов парафинового и ароматич. рядов), разл.
хлорсодержащих пестицидов, нек-рых в-в, не содержащих хлор,- сульфанила,
глицерина, этиленгликоля и т. п., для водоочистки. В мире на произ-во орг.
продуктов расходуется от 50 до 85% производимого X., на произ-во неорг.
продуктов - 10-15%, в целлюлозно-бумажной пром-сти - 2-15%, на очистку
воды и др. санитарные нужды - 2-10%.
Мировое произ-во X. в 1991-92 составило
40-45 млн. т.
X. весьма токсичен, во время 1-й мировой
войны его использовали как боевое ОВ. Содержание С12 в воздухе
0,006 мг/л оказывает раздражающее действие на дыхат. пути, 0,012 мг/л переносится
с трудом, концентрация выше 0,1 мг/л опасна для жизни: дыхание становится
частым, судорожным, паузы продолжительными, остановка дыхания наступает
через 5-25 мин. Вдыхание X. более высокой концентрации может привести к
мгновенной смерти в результате рефлекторного торможения дыхат. центра.
ПДК в воздухе рабочей зоны 1,0 мг/м3, в атмосфере населенных
пунктов разовая 0,1 мг/м3, среднесуточная 0,03 мг/м3.
Хранят X. в стальных баллонах зеленого
цвета.
X. открыл К. Шееле в 1774, элементарную
природу X. установили в 1807-13 Г. Дэви, Ж. Гей-Люссак и Л. Тенар.
Лит.: Пасманик М. И., Сасс-Тисовский Б. А., Якименко Л. М., Производство хлора и каустической соды. Справочник, М., 1966; Фурман А. А., Неорганические хлориды. (Химия и технология), М., 1980; Фрумина Н. С, Лисенко Н. Ф., ЧерноваМ. А., Хлор, М., 1983.
В. Я. Росоловский.

