Хлориты
ХЛОРИТЫ, соли хлористой к-ты НСlO2,
бесцв. или желтоватые кристаллы, устойчивы при обычных условиях в безводном
состоянии и в водном р-ре. В анионе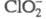 в зависимости от конкретной кристаллич. решетки длина связей С1 — О 0,1540
- 0,1570 нм, угол ОСlO 108,2-110,5°.
в зависимости от конкретной кристаллич. решетки длина связей С1 — О 0,1540
- 0,1570 нм, угол ОСlO 108,2-110,5°.
Хлористая к-та НС1О2 - слабая
неустойчивая к-та, при 25 С рКа 1,94;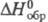 в бесконечно разб. водном р-ре -53,6 кДж/моль; за 9 ч при 40 °С и рН 4
распадается на 7%, а при рН 2 - на 80%:
в бесконечно разб. водном р-ре -53,6 кДж/моль; за 9 ч при 40 °С и рН 4
распадается на 7%, а при рН 2 - на 80%:
4НСlO2 НСlO3 + 2СlO2 + НС1 + Н2О
НСlO3 + 2СlO2 + НС1 + Н2О
Щелочные р-ры X. в темноте вполне устойчивы даже при кипячении, однако под действием света идет р-ция:
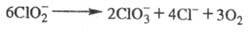
В кислой среде фотохим. распад идет по схеме:
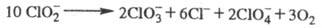
За 30 мин облучения при рН 8,94 степень
распада 50%, при рН 4,76 - 80%.
X.- окислители, окислит.-восстановит.
потенциал растет с уменьшением рН р-ра. В кислой среде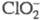 окисляет Вr- до Вr2,
окисляет Вr- до Вr2, и
и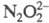 - до
- до NO - до NO2 (но не реагирует с N2O), H2O2
- до О2. Взаимод. с I2 протекает более сложно:
NO - до NO2 (но не реагирует с N2O), H2O2
- до О2. Взаимод. с I2 протекает более сложно:
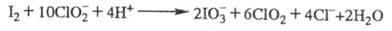
При р-ции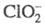 с С12 также образуются С1О2 и Сl-. При
рН
с С12 также образуются С1О2 и Сl-. При
рН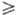 11 гипохлорит-ион
быстро и количественно окисляет
11 гипохлорит-ион
быстро и количественно окисляет до
до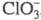 , именно
поэтому X. отсутствуют в продуктах р-ции С12 с водными р-рами
щелочей. Но уже при рН < 9 окисление гипохлоритом идет только до С1О2:
, именно
поэтому X. отсутствуют в продуктах р-ции С12 с водными р-рами
щелочей. Но уже при рН < 9 окисление гипохлоритом идет только до С1О2:
2NaClO2 + NaClO + Н2О 2СlO2 + NaCl + 2NaOH
2СlO2 + NaCl + 2NaOH
Эту р-цию используют в нек-рых методах
хлоритного беления.
Термич. стабильность X. щелочных металлов
растет не от Li к Cs, а от Cs к Li, что отличает X. от большинства солей
кислородных к-т. При медленном нагревании и в изотермич. условиях происходит
сильно экзотермич. диспропорционирование без выделения газа (ЗМСlО2——>
2МС1О3 + МС1); LiClO2 разлагается при 150-180 °С,
КСlO2 - при 135-160 °С, RbClO2 - при 100-140 °С,
RbClO2 - при 90-120 °С, CsClO2 -при 50-100 °С. При
быстром нагревании образуются МС1 и О2, в присут. оксидов переходных
металлов или примеси орг. в-в р-ция может принять взрывной характер.
X. натрия NaClO2 - кристаллы
моноклинной сингонии (пространств. группа I2/а); плотн. 2,468
г/см3;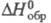 -311,3 кДж/моль; р-римость в воде при 25 °С 75,8 г в 100 г, в этаноле -
60 г/л. Ниже 37,4 °С из водных р-ров выделяется в виде NaClO2 x3H2O
- кристаллы триклинной сингонии (пространств. группа
-311,3 кДж/моль; р-римость в воде при 25 °С 75,8 г в 100 г, в этаноле -
60 г/л. Ниже 37,4 °С из водных р-ров выделяется в виде NaClO2 x3H2O
- кристаллы триклинной сингонии (пространств. группа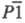 ;
;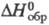 -1197 кДж/моль. X. др. металлов изучены мало. В пром-сти NaClO2
применяют для отбеливания тканей. Получают его восстановлением СlO2
в щелочной среде. В качестве восстановителей используют уголь, цинковую
пыль, Н2О2, РbО и т. п. Одно из техн. названий NaClO2
"текстон".
Токсичность X. примерно такая же, как у хлоратов.
-1197 кДж/моль. X. др. металлов изучены мало. В пром-сти NaClO2
применяют для отбеливания тканей. Получают его восстановлением СlO2
в щелочной среде. В качестве восстановителей используют уголь, цинковую
пыль, Н2О2, РbО и т. п. Одно из техн. названий NaClO2
"текстон".
Токсичность X. примерно такая же, как у хлоратов.
В. Я. Росоловский.

