Основания органические
ОСНОВАНИЯ ОРГАНИЧЕСКИЕ,
орг. соед., используемые на практике в качестве акцепторов протонов. К ним
относят нейтр. основания (третичные амины, амидины) и анионные основания [алкоголяты
и алтсил(или арил)амиды щелочных металлов, металлоорг. соед.]. К специфич. типам
О. о. относят также ангидрооснования (см. Кислоты и основания)и псевдооснования.
О. о. применяют прежде всего для ионизации соед. по связям О—Н, N—Н, С—Н.
Ионизирующая способность О. о. характеризуется константой ионизации сопряженной
к-ты рКа (см. табл.). Важное преимущество их перед щелочами
- р-римость в орг. р-рителях, что позволяет применять О. о. в неводных средах.
КОНСТАНТЫ ИОНИЗАЦИИ
НЕКОТОРЫХ ОРГАНИЧЕСКИХ ОСНОВАНИЙ В ВОДНОМ РАСТВОРЕ ПРИ 25 °С
|
Соединение |
Ф-ла |
рк. |
||
|
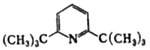
2,6-Ди-трет-бутилпиридин |
|
4,95 |
||
|
N,N-Диметиланилин |
С6Н5N(СН3)2 |
5,10 |
||
|
Пиридин |
C5H5N |
5,23 |
||
|
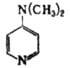
4-Диметиламинопиридин |
|
9,37 |
||
Продолжение табл.
|
Соединение Триэтиламин |
Ф-ла (C2H5)3N |
рка 10,67 |
||
|
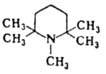
1,2,2,6,6-Пентаметилпиперидин |
|
11.25 |
||
|
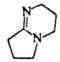
1,5-Диазабицикло
[4.3.0]нон-5-ен (ДБН) |
|
~12 |
||
|
Метилат натрия |
CH3ONa |
~16 |
||
|
Этилат натрия |
C2H5ONa |
~18 |
||
|
трет-Бутилат
калия |
трет-C4H9OK |
~19 |
||
|
Диизопропиламид
лития |
[(CH3)2CH]2NLi |
~35 |
||
|
Бутиллитий |
C4H9Li |
~40 42 |
||
Третичные амины относят
к мягко действующим основаниям, в отличие от щелочей они не вызывают гидролиза
сложноэфирных связей или лабильных связей С—Hal. Напротив, у анионных оснований
ионизирующая способность намного сильнее, чем у щелочей.
Широкое применение в орг.
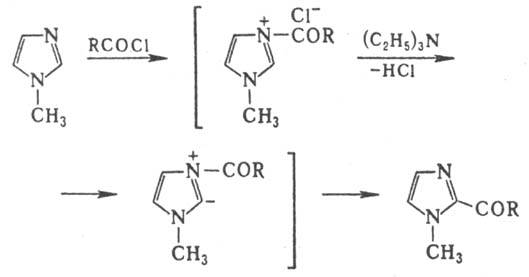
синтезе находит триэтиламин. Так, ацилирование 1-метилимидазола в его присут.
протекает в положение 2. Роль триэтиламина заключается в ионизации связи С-2—Н
в катионе 1-ацил-3-метилимидазо-лия. что обеспечивает перенос ацильной группы
к атому С-2:
При О-ацилировании фенолов
для ионизации связи О—Н используют пиридин или его 4-диметиламинопроизводное;
напр., в присут. последнего ацетилируется мезитол:
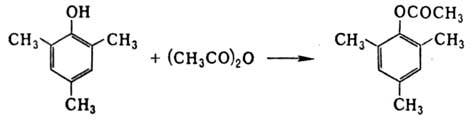
Для дегидрогалогенирования
соед., содержащих чувствительные к щелочам и др. сильным основаниям группировки,
применяют ДБН, к-рый, напр., превращает хлорацетилены, содержащие сложноэфирную
группировку, в сопряженные енины:
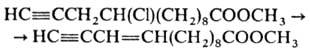
Для изомеризации ацетиленов
с неконцевой тройной связью в ацетилены с концевой тройной связью используют
3-аминопропиламид калия NH2CH2CH2CH2NHK:
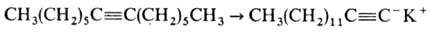
Все большее применение
находят т. наз. пространственно-затрудненные О. о., напр. 2,6-ди-трет-бутилпиридин,
пента-метилпиперидин
и др. Благодаря экранированию оснбвного центра алкильными группами, они практически
не проявляют нуклеоф. св-в, т.е. не взаимод. с льюисовскими кислотными центрами
(положительно заряженными атомами углерода, ионами металлов и т. п.), но сохраняют
способность присоединять протон. Так, пентаметилпиперидин [C5H6N(CH3)5],
полностью лишенный способности алкили-роваться, с успехом используется для связывания
галогено-водорода при исчерпывающем алкилировании алкилами-нов:
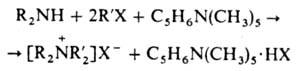
Пространственно-затрудненные
этилдициклогексиламин и этилдиизопропиламин (основания Хюнига) рекомендовано
использовать для превращ. a-галогенир. простых эфиров в винилалкиловые эфиры
(выход > 80%):
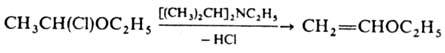
Нек-рые О. о., получившие
назв. протонных гарпунов, обладают уникальной способностью ионизировать слабые
к-ты по связям С—Н, не затрагивая при этом др. лабильные группы. Так, под действием
диизопропиламида Li 4,6-ди-хлорпиримидин подвергается не нуклеоф. замещению
подвижных атомов Сl, а металлированию:
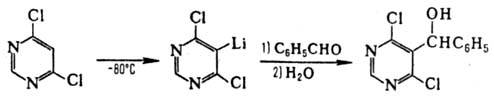
Аналогично действие тетраметилпиперидида
Li (ф-ла I), к-рый металлирует сложные эфиры карбоновых к-т, содержащих  -Н-атом,
не затрагивая сложно-эфирную группировку:
-Н-атом,
не затрагивая сложно-эфирную группировку:
; 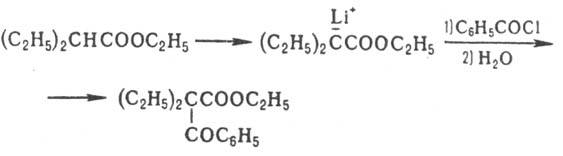
О. о. иногда используют
для активации металлоорг. соединений. Напр., активность бутиллития значительно
повышается в присут. 1,4-диазабицикло[2.2.2]октана (ДАБЦО; II) или тетраметилэтилендиамина
(ТМЭДА), что объясняется координацией N-атомов этих соед. с ионом лития, к-рый
таким образом отделяется от карбаниона и не так сильно нейтрализует его отрицат.
заряд.
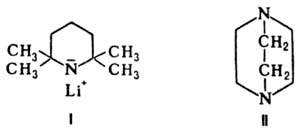
См. также Алкоголяты,
1,8-бис-(Диметиламино)нафталин, Металлоорганические соединения.
Лит.: Физер Л.,
Физер М., Реагенты для органического синтеза, пер. с англ., т. 1-7, М., 1970-78;
Общая органическая химия, пер. с англ., т. 3, М., 1982, с. 53-77; Каnnег В.,
"Heterocycles", 1982, v. 18, special issue, p. 411-19.
А. Ф. Пожарский.