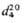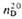Органогалогенсиланы
ОРГАНОГАЛОГЕНСИЛАНЫ,
кремнийорг. соединения со связями Si — Hal. О.-бесцв.,
дымящие на воздухе жидкости, с резким запахом; гидролитически стойкие О. (напр.,
триорганофторсила-ны)-без запаха либо со слабым эфирным запахом; О. с тремя
арильными или высшими алкильными радикалами-кристаллич. в-ва (см. табл.).
СВОЙСТВА НЕКОТОРЫХ ОРГАНОГАЛОГЕНСИЛАНОВ
|
Соединение |
Т. пл., °С |
Т. кип., °С |
|
|
||
|
Диметилдибромсилан
(CH3)2SiBr2 |
-58 |
112 |
1,727 |
1,469* |
||
|
Диметилдифторсилан (CH3)2siF2. |
-87 |
2/748 мм рт. ст. |
- |
|
||
|
Триметилиодсилан
(CH3)3SiI |
- |
106/734 мм рт.
ст. |
1,470 |
1,474 |
||
|
Триметилбромсилан
(CH3)3SiBr |
-43 |
80 |
1,172 |
1,422 |
||
|
Триметилфторсилан
(CH3)3SiF |
-74 |
19/730 мм рт. ст. |
0,793** |
- |
||
|
Этилтрибромсилан
C2H5SiBr3 |
-80 |
160/750 мм рт.
ст. |
2,079 |
1,515* |
||
|
Этилтрифторсилан
C2H5SiF3 |
-105 |
-4 |
1,227*** |
_ |
||
|
Диэтилдииодсилан
(C2H5)2SiI2 |
_ |
221 |
1,971 |
1,571 |
||
|
Винилтрихлорсилан
CH2=CHSiCl3 |
_. |
92 |
1,242 |
1,429 |
||
|
Метилвинилдихлорсилан
(CH3)(CH2=CH)SiCl2 |
_ |
93 |
1,086 |
1,427 |
||
|
Хлорметилтрихлорсилан
ClCH2SiCl3 |
- |
116/750 мм рт.
ст. |
1,444 |
1,453 |
||
|
Трифенилхлорсилан
(C6H5)3SiCI |
97 |
378 |
- |
- |
||
|
Метилфенилдихлорсилан
(CH3)(C6H5)SiCl2 |
_ |
203 |
1,182 |
1,518 |
||
|
Трифенилбромсилан
(C6H5)3SiBr |
120 |
201/1 мм рт. ст. |
|
- |
||
|
Фенилтрифторсилан
C6H5SiF3 |
-19 |
101 |
1,216 |
1,411 |
||
|
Пентаметилхлордисилан
(CH3)3SiSi(CH3)2Cl |
_ |
135 |
0,868 |
1,443 |
||
|
бис-(Диметилхлорсилил)
метан [Cl(CH3)2Si]2CH2 . |
_ |
175 |
1,016 |
1,448 |
||
|
(Изоцианато) диметилхлорсилан
(OCN)(CH3)2SiCl |
- |
103 |
1,075 |
1,414 |
||
|
Метилхлорметилдихлорсилан
(CH3)(ClCH2)SiCl2 |
- |
121,5 |
1,285 |
1,450 |
||
|
b-Цианоэтилметилдихлорсилан
(CH3)(NCCH2CH2)SiCl2 .... |
- |
215,75 |
1,201 |
1,455 |
||
* При 25°С. ** При
0°С. *** При -76°С.
Устойчивость О. к нагреванию
зависит от природы орг. радикала у атома Si, энергии и степени ионности связи
Si — Hal и понижается в ряду: Si—F (энергия связи 561,46 кДж/моль, степень ионности
70%) > Si—Cl (377,1 кДж/моль, 30%) > Si —Вг (305,87 кДж/моль, 22%) >
Si—I (230,45 кДж/моль, 8%). Так, (CH3)3SiF не разлагается
при нагр. до 600 °С, PhSiСl3-до 400 °С, а бром-и исдсодержащие
О. разлагаются при нагр. при более низких т-рах. О. образуют азеотропные смеси
с орг. и кремнийорг. сосд., а также комплексы с аминами, диэтиловым эфиром и
др.
Для О. характерны р-ции
нуклеоф. замещения. Гидролиз и гидролитич. конденсация О. в зависимости от условий
процесса приводят к силанолам или силоксанам (см. Орга-носилоксаны):
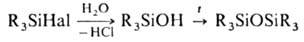
О. вступают в р-ции со
спиртами, алкоголятами щелочных металлов, орг. и неорг. к-тами и их солями,
реактивами Гриньяра. Аммонолиз и аминолиз органохлорсиланов в зависимости от
природы орг. радикала у атома Si, амина и условий р-ции приводит либо к образованию
аминосилиль-ных производных, либо к силазанам (см. Органосилазаны):
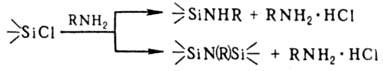
R = Alk, Ar, H При взаимодействии
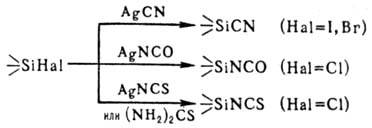
О. с цианидом, изоцианатом, тио-изоцианатом Ag (или тиомочевиной) образуются
соотв. циано-, изоцианато- и тиоизоцианатоорганосиланы:
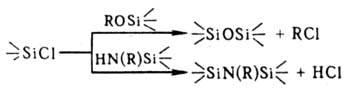
Гетерофункцион. конденсация
О. с силанолами, алкокси-, ацилокси- и аминосиланами приводит к образованию
мономеров, используемых в синтезе линейных и циклич. олигомеров и полимеров
(см. Кремнийорганические полимеры), напр.:
При взаимодействии О. с
металлич. Na при 110-140 °С образуются ди-, три- и полиорганосиланы: 2R3SiCl
+ + 2Na 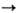 R3SiSiR3 + 2NaCl. Таким путем получены поли-диметилсиланы
[—(CH3)2Si—]n с высокой мол. массой.
R3SiSiR3 + 2NaCl. Таким путем получены поли-диметилсиланы
[—(CH3)2Si—]n с высокой мол. массой.
С оксидами металлов О.
реагируют с образованием орга-носилоксанов. О. способны также расщеплять силоксановые
связи, на чем основаны лаб. и пром. синтезы т. наз. теломеров:
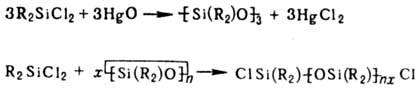
О. способны к обмену галогенов,
что используют в лаб. практике, напр.:

Для О. характерны р-ции
диспропорционирования, к-рые являются одним из методов синтеза галогенкарбосиланов,
налр.:
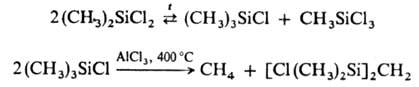
Практич. значение имеет
хлорирование О. по орг. радикалу, для к-рого разработаны фотохим., каталитич.
жидкостные и парофазные методы. Нежелат. побочный процесс в этих р-циях- отрыв
орг. радикала:
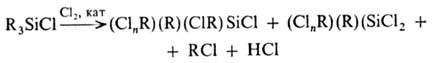
В качестве хлорирующих
агентов используют также S2Cl2 и SO2Cl2,
катализаторы-соли Fe, AlCl3, PCl3, SbCl3, I2
и др. Для метильных производных проходит селективное хлорирование одной и той
же группы вплоть до образования ССl3-производных. Галоген в орг.
радикале м. б. замещен на амино-, карбокси-, циано- и др. группы.
Осн. методы синтеза. 1)
Взаимод. SiCl4 с реактивами Гриньяра:
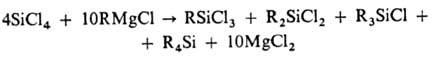
Этот метод применяют в
пром-сти для получения О. с разл. орг. радикалами у атома Si. Можно использовать
также литий-, цинк- и натрийорг. соединения. 2) Прямой синтез (наиб. экономичный
из пром. методов) - взаимод. алкил-и арилгалогенидов с кремнием при 250-350
или 500-600 °С соотв. в присут. Сu или с использованием кремнемедного сплава
в реакторах с мех. перемешиванием в псевдоожижен-ном слое, в вибрац. режиме
или под давлением:
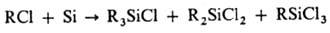
3) Высокотемпературное
дегидрохлорирование смеси орг. галогенидов и орг. или неорг. гидридхлорсиланов;
газообразную смесь пропускают через трубчатый реактор при 500-650 °С в течение
10-100 с:
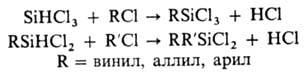
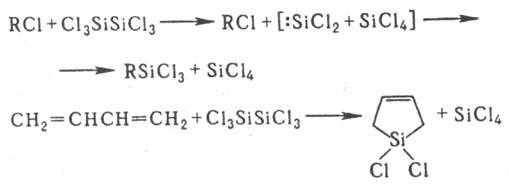
Взаимод. гексахлордисилана
с алкилхлоридами приводит к алкилтрихлорсиланам, а с ненасыщенными соед.- к
циклическим О., напр.:
Алифатич. хлориды в этой
р-ции восстанавливаются до углеводородов, напр.: SiHCl3 + СН3Сl
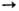 SiCl4
+ СН4.
SiCl4
+ СН4.
4) Дегидрирование и т.
наз. гидридное присоединение в присут. [H2(PtCl)6]·6H2O:
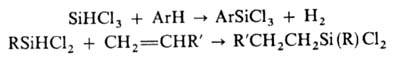
5) Для получения чистых
О. в лаб. практике используют расщепление силоксановой связи, а для синтеза
О., галогени-рованных в орг. радикал,- диазометод Несмеянова:
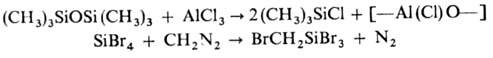
О.-базовые полупродукты
для произ-ва кремнийорг. соединений. На практике обычно используют метил-, этил-,
винил- и фенилхлорсиланы. О. применяют также как гидро-фобизирующие агенты для
стекла, бумаги, кожи, волокон, керамики и др., в качестве пропитывающих в-в
в электротехнике, антифрикц. пленкообразователей для стеклянных и металлич.
поверхностей. В лаб. практике О. применяют для силилирования.
Низкокипящие О.-горючие
соед., а О. со связями Si—Н образуют взрывоопасные смеси с воздухом. Пропилтри-фторсилан
- лакриматор, бутилтрифторсилан - сильный яд.
Лит. см, при ст. Кремнийорганические соединения. В. Н. Емельянов.