Олова галогениды
ОЛОВА ГАЛОГЕНИДЫ. Известны
простые ди- и тетра-галогениды SnX2 и SnX4 (см. табл.),
смешанные галогениды 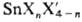 , оксогалогениды, а также комплексные - галогено-станнаты. 8пС14-бесцв.
жидкость, остальные - кристаллы; хлориды и фториды Sn, а также SnBr4
бесцветны. Тетра-галогениды - к-ты Льюиса, по силе их можно расположить в ряд
SnCl4 " SnBr4 > SnI4. Наиб. практич.
значение имеют хлориды Sn.
, оксогалогениды, а также комплексные - галогено-станнаты. 8пС14-бесцв.
жидкость, остальные - кристаллы; хлориды и фториды Sn, а также SnBr4
бесцветны. Тетра-галогениды - к-ты Льюиса, по силе их можно расположить в ряд
SnCl4 " SnBr4 > SnI4. Наиб. практич.
значение имеют хлориды Sn.
Тетрахлорид SnCl4 дымит на воздухе вследствие гидролиза; tкрит 318,7°С, pкрит 3,7 МПа; ур-ние температурной зависимости давления пара: lg р(Па) = 12,87-1925/T (298-388 К). Хорошо смешивается с водой, при этом объем р-ра заметно меньше суммы объемов компонентов. Из горячих конц. водных р-ров при охлаждении до 83-63°С выделяется тригидрат, при 63-56 °С-тетрагидрат, при 56-19°С-пентагидрат, ниже 19°С-октагидрат. Разб. р-ры SnCl4 гидролизуются, в р-рах образуется также Н2 [SnCl6].
СВОЙСТВА ГАЛОГЕНИДОВ
ОЛОВА
|
Показатель |
SnF4 |
SnCl4 |
SnBr4 |
SnI4 |
|
SnCl2, |
SnBr, |
SnI2, |
||
|
Сингония |
Тетрагон. |
|
Моноклинная |
Кубич. |
Моноклинная |
Ромбич. |
Ромбич. |
Моноклинная |
||
|
Параметры элементарной
ячейки: |
|
|
|
|
|
|
|
|
||
|
а, нм |
0,4048 |
- |
1,059 |
1,225 |
1,346 |
0,779 |
- |
1,429 |
||
|
b, нм |
- |
- |
0,710 |
- |
0,492 |
0,921 |
- |
0,453 |
||
|
с, нм |
0,793 |
- |
1,066 |
- |
1,386 |
0,443 |
- |
1,072 |
||
|
угол, град |
_ |
_ |
103,9 |
_ |
109,5 |
_ |
_ |
92 |
||
|
Пространств. группа |
I4/ттт |
_ |
P21/c |
Pa3 |
P21/c |
Рhaт |
_ |
Cm |
||
|
Число формульных
единиц в ячейке |
2 |
_ |
|
8 |
16 |
4 |
_ |
6 |
||
|
Т. кип., оС |
705* |
114 |
202 |
364,5 |
853 |
652 |
620 |
717 |
||
|
Т.пл., °С |
_ |
-33 |
31 |
144,5 |
215,0 |
246 |
215,5 |
320 |
||
|
Плотн., г/см3 |
4,78 |
2,23 |
3,34 (35 °С) |
4,5 |
4,87** |
3,95 |
5,12 |
5,19 |
||
|
|
|
165,3 |
|
85,0 |
72,4 |
78,0 |
|
|
||
|
|
- |
-528,8 |
-405,8 |
- |
-650 |
-333 |
-260 |
-145,2 |
||
|
|
- |
258,5 |
264,7 |
- |
96,2 |
134,0 |
- |
- |
||
* Т-ра возгонки. ** Плотн.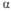 -SnF2
5,33 г/см3.
-SnF2
5,33 г/см3.
Тетрахлорид раств. в этаноле,
диэтиловом эфире и нек-рых др. орг. р-рителях; растворяет S, Р, галогены; с
Сl2 дает эвтектику при -106°С, содержащую 86% хлора. Хлориды
Fe, Al, Та, Nb частично раств. в SnCl4. Тетрахлорид - окислитель;
склонен к р-циям присоединения, легко образует комплексные соед. с НСl, NH3,
PCl5. Так, из смеси р-ров SnCl4 и NH4Cl кристаллизуется
гексахлоростаннат (NH4)2 [SnCl6], к-рый возгоняется
при 400 °С. Гексахлоро-станнаты щелочных металлов разлагаются выше 600 °С.
Известны аддукты SnCl4·NO, 3SnCl4·2PH3, продукты
присоединения спиртов, орг. сульфидов, аром, соед., эфиров и др. Получают SnCl4
взаимод. Sn с Сl2 (сильноэкзотермич. р-ция). Применяют для получения
Sn и оловоорг. соед., как катализатор полимеризации и др. р-ций, протраву при
крашении тканей, для утяжеления натурального шелка, как компонент светочувствит.
бумаги, для отделения Rb и Cs от К в аналит. химии.
Дихлорид SnCl2
в парах при 600-700°С димерен; ур-ние температурной зависимости давления
пара lg р (Па) = = 12,73-4480/T (677-902 К); р-римость в воде
83,8 г в 100 г при О °С. Из водного р-ра кристаллизуется дигидрат, в разб.
водных р-рах гидролизуется. В присут. небольших кол-в НСl р-римость SnCl2
в воде уменьшается, но при высокой кислотности повышается. SnCl2
хорошо раств. в этаноле, диэтиловом эфире, ацетоне, пиридине и др. орг. р-рителях;
р-ры SnCl2-сильные восстановители. Хлор окисляет SnCl2 до
SnCl4, О2-до оксохлорида. С аммиаком SnCl2
образует аммиакаты SnCl2·nNH3 (n = 1, 4,
9), с хлоридами металлов-комплексные соед., напр. K[Sn2Cl5]
(т. пл. 218 °С), К [SnCl3] (т. пл. 255 °С), Sn [Аl2Сl8]
(т. пл. 209 °С), Sn [A1C15] (т. пл. 158,5СС), Sn[Ta2Cl12]
(т. пл. 239 °С). Получают SnCl2 взаимод. Sn с Сl2,
НСl или хлоридами др. металлов. Применяют как катализатор полимеризации эпоксидов,
восстановитель в орг. синтезе, протраву при крашении тканей, для обработки пов-сти
стекла и пластмасс перед металлизацией для повышения адгезии, как компонент
флюса при сварке, для получения Sn, как реагент для определения Сl2,
I,, Hg2+, Fe3 + и др., для обесцвечивания нефтяных
масел. Тетрафторид SnF4 хорошо раств. в холодной воде, не раств.
в большинстве орг. р-рителей, раств. в горячем ТГФ. Образует гексафторостаннаты
щелочных металлов M2[SnF6], а также (NH4)4
[SnF8], K3H[SnF8] и др. Получают SnF4
либо фторированием SnCl4, либо прямым взаимод. Sn и F2.
Дифторид SnF2 кристаллизуется в ромбич. (a) и моноклинной (b) модификациях,
хорошо раств. в воде, этаноле, диэтиловом эфире, практически не раств. в СНСl3;
с фторидами щелочных металлов и аммония образует соед. М [SnF3],
известен также Na [Sn2F5]; получают взаимод. SnO с газообразным
HF. Применяют как компонент зубных паст, флюсов для пайки, твердых электролитов
и электролитов для лужения.
Тетрабромид SnBr4
и тетраиодид SnI4 получают взаимод. Sn соотв. с Вг2 и
I2. Из водного р-ра при обычной т-ре
SnBr4 кристаллизуется в виде тетрагидрата. Гексабро-мооловянная к-та
Н2 [SnBr6]·8Н2О-бесцв. расплывающиеся на воздухе
кристаллы; известны гексабромостаннаты (IV) М2 [SnBr6].
Тетраиодид образует сильно светопреломляю-щие кристаллы, окрашенные от желтого
до желто-коричневого цвета; раств. в CS2, этаноле, диэтиловом эфире,
бензоле и др. орг. р-рителях; гидролизуется водой, поэтому иодостаннаты нельзя
получить из водного р-ра. Дибромид SnBr2-желтые кристаллы; хорошо
раств. в воде, в р-рах гидролизуется. Дииодид SnI2-оранжево-красные
кристаллы, слабо раств. в воде. SnI2 и SnBr2 раств. в
метаноле; по хим. св-вам сходны с SnCl2 и образуют аналогичные комплексные
соединения.
Получены смешанные галогениды:
SnBr3Cl (т. пл. 1,0°С, т. кип. 73 °С, плотн. 3,12 г/см3),
SnBrCl3 (т. пл. -1,0°С, т. кип. 50 °С, плотн. 2,51 г/см3)
и др.
Лит.: Фурман А.
А., Неорганические хлориды (Химия и технология), М., 1980. См. также лит. при
ст. Олово. Н.П. Дергачева.


 -SnF,
-SnF, , Дж/(моль·К).
, Дж/(моль·К).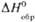 , кДж/моль
, кДж/моль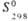 , Дж/(моль·К)
, Дж/(моль·К)