Церий
ЦЕРИЙ (от назв. малой планеты Цереры,
открытой незадолго до церия; лат. Cerium) Се, хим. элемент III гр. периодич.
системы; относится к редкоземельным элементам (цериевая подгруппа
лантаноидов), ат. н. 58, ат. м. 140,12. В природе 4 стабильных нуклида:
136Се
(0,19%), 138Се (0,25%), 140Се (88,48%),
142Се
(11,08%). Поперечное сечение захвата тепловых нейтронов 0,6 x 10-28
м2. Конфигурация внеш. электронных оболочек атома 4f25s25p66s2;степени
окисления +3, реже +4; энергия ионизации при последоват. переходе
от Се0 к Се4+ 5,47, 10,85, 20,198 и 36,758 эВ; электроотрицательность
по Полингу 1,12; атомный радиус 0,183 нм, ионные радиусы (в скобках даны
координац. числа) Се3+ 0,115 (6), 0,121 (7), 0,128 (8), 0,134
(9), 0,139 (10), 0,148 нм (12), Се4+ 0,101 (6), 0,111 (8), 0,121
(10), 0,128 (12) нм.
Содержание в земной коре 7 х 10-3
%
по массе, в морской воде 1,3 х 10-6 мг/л. Ц. наиб. распространен
среди легких лантаноидов, поэтому подгруппу элементов от La до Еu наз.
цериевой. Вместе с др. РЗЭ содержится в монаците, бастнезите, апатитах
и др. минералах. В них содержание Ц. колеблется в интервале 25-55% от суммарного
кол-ва РЗЭ.
Свойства. Ц.- серебристо-белый металл;
известно 4 кристаллич. модификации: ниже 95 К существует кубич.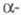 форма
со структурой типа Сu, а = 0,485 нм, z = 4, пространств.
гр. Fm3m; в интервале 95-264 К - гексагон.
форма
со структурой типа Сu, а = 0,485 нм, z = 4, пространств.
гр. Fm3m; в интервале 95-264 К - гексагон.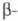 форма
с решеткой типа La, а = 0,3673 нм, с = 1,1802 нм, z =
4,
пространств. гр. P63/mmc; в интервале 263-1035
К -
форма
с решеткой типа La, а = 0,3673 нм, с = 1,1802 нм, z =
4,
пространств. гр. P63/mmc; в интервале 263-1035
К -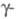 форма
с кубич. решеткой типа Сu, а = 0,51612 нм, пространств. гр. Fm3m;выше
1035 К существует d-форма
с кубич. решеткой типа a-Fe,
а
=
0,412 нм, z = 2, пространств. гр. 1тЗт. Т. пл. 798 °С, т. кип. 3467
°С; плотн.
форма
с кубич. решеткой типа Сu, а = 0,51612 нм, пространств. гр. Fm3m;выше
1035 К существует d-форма
с кубич. решеткой типа a-Fe,
а
=
0,412 нм, z = 2, пространств. гр. 1тЗт. Т. пл. 798 °С, т. кип. 3467
°С; плотн.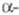 Се
8,23 г/см3,
Се
8,23 г/см3,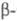 Се
6,66 г/см3,
Се
6,66 г/см3,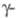 Се
6,768 г/см3,
Се
6,768 г/см3,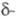 Се
6,70 г/см3, т-ра перехода
Се
6,70 г/см3, т-ра перехода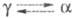 300 К при давлении 103 МПа;
300 К при давлении 103 МПа;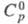 26,94 Дж/(моль x К);
26,94 Дж/(моль x К);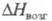 417,1 кДж/моль,
417,1 кДж/моль,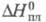 5,23 кДж/моль (1077 К),
5,23 кДж/моль (1077 К),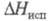 409 кДж/моль (3720 К);
409 кДж/моль (3720 К);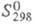 71,5 Дж/(моль x К); давление пара 1,06 x 105 Па (2000 К); температурный
коэф. линейного расширения 8,5 x 10-6 К-1, р 75,3
x 10-8 Ом x м; теплопроводность 11,2 Вт/(м x К) при 291 К; магн.
восприимчивость +17,30 x 10-9; точка Нееля 12,5 К; модуль упругости
30,58 ГПа, модуль сдвига 12,23 ГПа; коэф. Пуассона 0,248;
71,5 Дж/(моль x К); давление пара 1,06 x 105 Па (2000 К); температурный
коэф. линейного расширения 8,5 x 10-6 К-1, р 75,3
x 10-8 Ом x м; теплопроводность 11,2 Вт/(м x К) при 291 К; магн.
восприимчивость +17,30 x 10-9; точка Нееля 12,5 К; модуль упругости
30,58 ГПа, модуль сдвига 12,23 ГПа; коэф. Пуассона 0,248;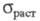 123 МПа; относит. удлинение 32,6%. Ц.- ковкий и вязкий металл, при комнатной
т-ре без нагревания легко куется (инертная атмосфера) и прессуется, легко
поддается мех. обработке (инертная атмосфера).
123 МПа; относит. удлинение 32,6%. Ц.- ковкий и вязкий металл, при комнатной
т-ре без нагревания легко куется (инертная атмосфера) и прессуется, легко
поддается мех. обработке (инертная атмосфера).
На воздухе компактный Ц. окисляется за
неск. суток, причем кусок рассыпается, образуя серый порошок гидратированных
карбонатов. При нагр. на воздухе компактный Ц. загорается при 160-180 °С,
порошок пирофорен. Ц. разлагает воду при кипячении, раств. в минеральных
к-тах, относительно устойчив к действию щелочей. Бурно взаимод. с галогенами,
халькогенами, азотом, углеродом с образованием производных Се(III) или
Ce(IV).
Ионы Се(III) в водном р-ре относительно
устойчивы, но окислителями (особенно в щелочной среде) способны переводиться
в Ce(IV).
Химия Се(III) весьма сходна с таковой
для др. РЗЭ, а также с химией актиноидов(III). Для Ce(IV) известны разнообразные
комплексные соед., в т. ч. с ацидолигандами (Сl-,
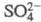 ), похожие по св-вам на аналогичные производные Th(IV). Ион Се4+
- сильный окислитель (стандартный электродный потенциал CeIV/CeIII
1,66 В), что широко используется в титриметрич. определении восстановителей
(цериметрии). Способность Се(III) к переходу в форму Ce(IV) используют
для экстракционной очистки Ц. от др. РЗЭ.
), похожие по св-вам на аналогичные производные Th(IV). Ион Се4+
- сильный окислитель (стандартный электродный потенциал CeIV/CeIII
1,66 В), что широко используется в титриметрич. определении восстановителей
(цериметрии). Способность Се(III) к переходу в форму Ce(IV) используют
для экстракционной очистки Ц. от др. РЗЭ.
ХАРАКТЕРИСТИКА НЕКОТОРЫХ СОЕДИНЕНИЙ
ЦЕРИЯ
|
Показатель
|
СеO2
|
(NH4)2[Се(NО3)6]
|
ВаСеO3
|
Cs[CeCl6]
|
CeF4
|
CeF3
|
|
Цвет
|
Светло-желтый
|
Оранжево -красный
|
Бесцв.
|
Желтый
|
Бесцв.
|
Бесцв.
|
|
Сингония
|
Кубич.
|
Моноклинная
|
Ромбич.
|
Ромбоэдрич.
|
Моноклинная
|
Тригон.
|
|
Параметры решетки:
а,
нм
|
0,54110
|
1,3061
|
0,6212
|
0,7465
|
1,2625
|
|
|
b,
нм
|
—
|
0,6842
|
0,6235
|
—
|
1,0589
|
_
|
|
с, нм
|
—
|
0,8183
|
0,8781
|
0,6029
|
0,8257
|
—
|
|
угол, град.
|
—
|
91,34
|
—
|
—
|
126,20
|
—
|
|
Число формульных
единиц в ячейке
|
4
|
2
|
4
|
1
|
12
|
—
|
|
Пространств.
группа
|
Fm3m
|
Р21/п
|
Рbпт
|
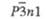 |
С2/с
|
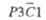 |
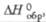 кДж/моль
кДж/моль |
-1090,4
|
—
|
—
|
—
|
-1962
|
-1690,3
|
Соединения, содержащие Се3+,
бесцветны, ионы Се4+ желтые или желто-оранжевые. Комплексные
соединения Ce(IV) с орг. лигандами окрашены более глубоко.
Диоксид СеО2 (табл.) имеет
т. пл. 2400 °С,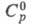 61,63 Дж/(моль x К),
61,63 Дж/(моль x К),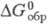 -1024,5 кДж/моль,
-1024,5 кДж/моль,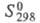 62,30 Дж/(моль x К); раств. в конц. HNO3, H2SO4
в присут. HF, Н2О2 или ионов
62,30 Дж/(моль x К); раств. в конц. HNO3, H2SO4
в присут. HF, Н2О2 или ионов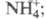 с Н2 выше 800 °С реагирует и дает оксиды, содержащие одновременно
Се(III) и Ce(IV) (окраска от черной до фиолетовой). СеО2 получают
прокаливанием нитрата сульфата, оксалата, карбоната и др. соед. на воздухе
выше 800 °С. Используют СеО2 для полировки оптич. и техн. стекол,
как компонент стекол, керамик (напр., оксоцератов МIIСеО3,
ВаРbСеТiO3), как промежут. продукт при получении Ц. и его соединений.
ПДК в воздухе рабочей зоны 5 мг/м3. Сесквиоксид Се2O3
неустойчив, в присут. О2 быстро окисляется с выделением большого
кол-ва тепла.
с Н2 выше 800 °С реагирует и дает оксиды, содержащие одновременно
Се(III) и Ce(IV) (окраска от черной до фиолетовой). СеО2 получают
прокаливанием нитрата сульфата, оксалата, карбоната и др. соед. на воздухе
выше 800 °С. Используют СеО2 для полировки оптич. и техн. стекол,
как компонент стекол, керамик (напр., оксоцератов МIIСеО3,
ВаРbСеТiO3), как промежут. продукт при получении Ц. и его соединений.
ПДК в воздухе рабочей зоны 5 мг/м3. Сесквиоксид Се2O3
неустойчив, в присут. О2 быстро окисляется с выделением большого
кол-ва тепла.
Твердые комплексные нитраты Ce(IV) с орг.
катионами при синтезе или хранении могут взрывать. Гексанитратоцерат(IV)аммония
(церий-аммонийнитрат) (NH4)2[Ce(NO3)6]
раств. в воде, этаноле, эфирах: разлагается выше 180 °С, в р-рах НС1, H2SO4
образует хлоронитратоцераты(IV), хлоросульфатоцераты(IV), легко разлагающиеся
при нагр. с выделением соотв. С12 или О2. Получают
при р-рении СеО2 в конц. HNO3 в присут. NH4NO3
и кипячении с послед. экстракцией диэтиловым эфиром и кристаллизацией из
этого р-ра. Используют при получении разл. соединений Ц., а также как промежут.
продукт при отделении Ц. от др. РЗЭ.
Церат(IV) бария ВаСеО3 не раств.
в воде и орг. р-рителях; получают взаимод. оксидов Ва и С1 при 1000 °С
в атмосфере О2; используют в качестве основы для керамич. материалов
радиоэлектроники.
Гексахлороцерат(IV)цезия Cs2CeCl6
раств. в конц. НС1, мало раств. в воде, но медленно разлагается; получают
осаждением ионами Cs+ из этанольного р-ра Н2СеС16
или из водного р-ра церий-аммонийнитрата в НС1; применяют при аналит. определении
цезия (весовая форма), при разделении щелочных металлов методом осаждения
(коэф. разделения Cs/Rb 66, Cs/K 3000, Cs/Na 5000).
Тетрафторид CeF4 при взаимод.
с водой гидролизуется; выше 700 °С в вакууме сублимирует без разложения;
окислитель, реагирует при нагр. с орг. соединениями, в т. ч. при 150-200
°С с фторопластами; получают при обработке Се, CeF3, СеС13,
СеО2, Се2О3, фтором, C1F3,
BrF3, XeF2 и др. выше 200-250 °С; фторирующий реагент
в орг. синтезе, используется в пиротехн. составах.
Трифторид CeF3 при действии
воды образует гидраты; получают р-цией СеО2 с HF при 500 °С,
термич. разложением (NH4)2CeF6 xnH20
при 300-330 °С, CeF4 x 7H2O - при 390-400
°С; применяют для получения Ц. металлотермич. способом.
Получение и применение.
Вьщеляют
Ц. из прир. смеси РЗЭ экстракцией и хроматографией. В одной из технол.
схем исходные оксиды РЗЭ, значит. часть к-рых (до 70%) приходится на СеО2,
кипятят в конц. HNO3 в присут. NH4NO3.
Образующийся при этом церий-аммонийнитрат экстрагируют [напр., с помощью
бис-(2-этилгексилового)
эфира фосфорной к-ты] и из экстракта выделяют СеО2.
Ц. используют в произ-ве пирофорных сплавов,
в т. ч. для трассирующих боеприпасов. Ц.- компонент ферроцерия и мишметалла
(применяют в произ-ве пирофорных сплавов, как раскислители и десульфураторы
в черной металлургии), лигатур (для модификации сплавов А1 и Mg); порошок
Ц. используют в качестве геттера.
Ц. (как смесь цериевых земель) открыли
Й. Берцелиус и В. Хизингер в 1803, независимо от них - М. Клапрот (1803).
Лит. см. при ст. Редкоземельные элементы.
Л. И. Мартыненко, С. Д. Моисеев, Ю.
М. Киселев.

