Цинка халькогениды
ЦИНКА ХАЛЬКОГЕНИДЫ, соед. Zn с халькогенами (табл.). При атм. давлении существуют в виде двух модификаций - стабильной кубической со структурой типа сфалерита (пространств. группа F43m, z = 4) и метастабильной гексагональной типа вюрцита (пространств. группа P63mc, z = 2). Возможно получение кристаллов со структурами, включающими кубич. (трехслойные) и гексагон. (двухслойные) упаковки. Особенно много политипных модификаций (до 150) известно у ZnS. При высоких давлениях все Ц. х. переходят в др. кубич. модификации со структурой типа NaCl (по др. данным, типа CsCl). Все Ц. х. могут иметь отклонения от стехиометрии, испаряются конгруэнтно с диссоциацией в парах на компоненты.
СВОЙСТВА ХАЛЬКОГЕНИДОВ ЦИНКА
|
Показатель
|
ZnS
|
ZnSe
|
ZnTe
|
||||
|
Цвет
|
Бесцв.
|
Желтый
|
Красный
|
||||
|
Сингония
|
Кубич.а
|
Гекса-гон.
|
Кубич.6
|
Гекса-гон.
|
Кубич.
|
Гекса-гон.
|
|
|
Параметры решетки,
нм:
а |
0,54109 |
0,38225 |
0,5656 |
0,3996 |
0,6085 |
0,4310 |
|
|
с
|
_
|
0,62613
|
_
|
0,6626
|
_
|
0,7090
|
|
|
Т. пл., °С
|
—
|
1820 (0,37 МПа)
|
—
|
1575 (0,053 МПа)
|
1305 (0,064 МПа)
|
~
|
|
|
Т. возг., °С
|
1178
|
1185
|
_
|
_
|
—
|
—
|
|
|
Плотн., г/см3
|
4,09
|
4,08
|
5,42
|
—
|
5,72
|
—
|
|
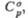 Дж/(моль х К)
Дж/(моль х К) |
45,5
|
—
|
50
|
—
|
49,7
|
—
|
|
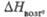 кДж/моль
кДж/моль |
149,8
|
265,3
|
—
|
—
|
—
|
—
|
|
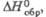 кДж/моль
кДж/моль |
-205
|
-192
|
-164
|
—
|
-119,2
|
—
|
|
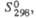 Дж/(моль х К)
Дж/(моль х К) |
57,7
|
—
|
84
|
—
|
92
|
—
|
|
|
Теплопроводность,
Вт/(см х К) |
0,026
|
—
|
0,19
|
—
|
0,18
|
—
|
|
|
Коэф. преломления
|
2,37
|
—
|
2,66
|
—
|
2,97
|
—
|
|
|
Ширина запрещенной
зоны, эВ
|
3,7
|
3,8
|
2,7
|
—
|
2,24
|
—
|
|
|
Эффективная масса:
электронов |
0,27 |
— |
0,17 |
— |
— |
— |
|
|
дырок
|
0,58
|
_
|
0,6
|
_
|
0,6
|
—
|
|
|
Подвижность,
см2/(В х с): электронов
|
200 |
140 |
530 |
— |
340 |
— |
|
|
дырок
|
5
|
—
|
28
|
—
|
110
|
—
|
|
аТ-ра полиморфного перехода
1175 °С,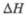 перехода
1,35 кДж/моль. бТ-ра полиморфного перехода 1145 °С,
перехода
1,35 кДж/моль. бТ-ра полиморфного перехода 1145 °С,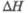 перехода 0,96 кДж/моль.
перехода 0,96 кДж/моль.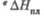 65 кДж/моль.
65 кДж/моль.
Модификации, существующие при атм. давлении,-
широкозонные полупроводники. У них наблюдается пьезоэлектрич. эффект. Модификации
высокого давления обладают металлич. проводимостью. Ц. х. обладают высокой
чувствительностью к электромагн. волнам, вплоть до самых коротких. Этим
обусловлены осн. области их применения - как люминофоров, сцинтилляторов,
материалов ИК оптики и т. п.
Для сульфида ZnS ур-ния температурной
зависимости давления пара: для сфалерита lg p (мм рт. ст.) = 10,571
— 13846/T (1095- 1435К); для вюрцита lg p (мм рт.ст.) = 9,842 -
13026/T (1482 - 1733 К). Переход в кубич. фазу III (а = 0,499 нм
при ~ 18 ГПа) наблюдается при давлении 16,4 ГПа, обратный переход - при
10-11 ГПа. ZnS в виде белого аморфного осадка (легко дающего коллоидные
р-ры) образуется при действии H2S или (NH4)2S
на нейтральные р-ры солей цинка. Свежеосажденный ZnS хорошо раств. в сильных
минеральных к-тах, но не раств. в уксусной к-те, р-рах щелочей, NH3,
сульфидов щелочных металлов. При стоянии осадок постепенно кристаллизуется,
что ведет к уменьшению р-римости в к-тах. Р-римость ZnS (в форме сфалерита)
в воде ~6 x 10-6 % по массе. Во влажном воздухе и в виде водной
суспензии медленно окисляется до ZnSO4. В орг. р-рителях не
раств. Т-ра воспл. на воздухе 755 °С.
Получают ZnS из Zn и S в режиме самораспространяющегося
высокотемпературного синтеза. Используют также гидротермальный метод: 3ZnO
+ 4S + 2NH3 + H2O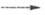 3ZnS + (NH4)2SO4, осаждение из водных р-ров - из
щелочных действием тиомочевины или из слабокислых (рН 2-3) действием H2S.
Монокристаллы выращивают из расплава методом направленной кристаллизации
под давлением Аr, из р-ра в расплаве, напр. РbС12, осаждением
из газовой фазы - в результате возгонки, взаимод. паров компонентов или
транспортными р-циями с I2 или NH4C1 в качестве носителя,
гидротермальным методом - из р-ра Н3РО4 или КОН.
Пленки сульфида выращивают обычно напылением.
3ZnS + (NH4)2SO4, осаждение из водных р-ров - из
щелочных действием тиомочевины или из слабокислых (рН 2-3) действием H2S.
Монокристаллы выращивают из расплава методом направленной кристаллизации
под давлением Аr, из р-ра в расплаве, напр. РbС12, осаждением
из газовой фазы - в результате возгонки, взаимод. паров компонентов или
транспортными р-циями с I2 или NH4C1 в качестве носителя,
гидротермальным методом - из р-ра Н3РО4 или КОН.
Пленки сульфида выращивают обычно напылением.
ZnS - люминофор для экранов электронно-лучевых
и рентгеновских трубок, сцинтилляторов и т. п., полупроводниковый материал,
компонент белого пигмента (см. Литопон). Прир. минералы сфалерит
и вюрцит (вюртцит) - сырье для извлечения Zn.
Дисульфид ZnS2 - кристаллы
с кубич. структурой типа пирита (а = 0,59542 нм, z = 4, пространств.
группа РаЗ); плотн. 5,56 г/см3, получают взаимод. с ZnS
и S при давлении 6,5 ГПа и 400-600 °С.
Для селенида ZnSe (кубич. модификация)
ур-ние температурной зависимости давления пара: lg p (мм рт. ст.)
= 9,436-12140/T(952-1209К). При давлении 13,5 ГПа переходит в кубич. металлич.
модификацию (а = 0,511 нм). ZnSe м. б. осажден из р-ра в виде лимонно-желтого,
плохо фильтрующегося осадка. Влажный ZnSe очень чувствителен к действию
воздуха. Высушенный или полученный сухим путем устойчив на воздухе, окисление
его с улетучиванием SeO2 начинается при 300-350 °С. Разлагается
разб. к-тами с выделением H2Se. Получают ZnSe взаимод. Zn с
Se, ZnS с H2SeO3 с послед, прокаливанием при 600-800
°С, при нагр. ZnS с SeO2 или смеси ZnO, ZnS с Se (2ZnO + ZnS
+ 3Se 3ZnSe
+ SO2). Предложен также метод нагревания смеси ZnO с Se и щавелевой
к-той. Монокристаллы селенида выращивают направленной кристаллизацией расплава
под давлением, осаждением из газовой фазы - возгонкой, взаимод. паров компонентов
или транспортными р-циями. Пленки получают из газовой фазы. ZnSe - лазерный
материал, компонент люминофоров. В природе - минерал штиллеит.
3ZnSe
+ SO2). Предложен также метод нагревания смеси ZnO с Se и щавелевой
к-той. Монокристаллы селенида выращивают направленной кристаллизацией расплава
под давлением, осаждением из газовой фазы - возгонкой, взаимод. паров компонентов
или транспортными р-циями. Пленки получают из газовой фазы. ZnSe - лазерный
материал, компонент люминофоров. В природе - минерал штиллеит.
Диселенид ZnSe2 со структурой
типа пирита (а = 0,62930 нм) получен из простых в-в под давлением
6,5 ГПа при 1000-1300 °С.
Теллурид ZnTe в зависимости от способа
получения -серый порошок, краснеющий при растирании, или красные кристаллы.
Гексаген, модификация при всех т-рах метаста-бильна, м. б. получена только
из газовой фазы; ур-ние температурной зависимости давления пара для кубич.
модификации: lg p (мм рт. ст.) = 9,718-11513/T (918-1095К). Под
давлением 8,5-9 ГПа превращается в кубич. фазу III, к-рая при 12-13,5 ГПа
переходит в гексаген, металлич. модификацию IV со структурой типа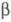 -Sn.
Устойчив на воздухе. Порошкообразный разрушается водой. В орг. р-рителях
не раств., минеральными к-тами разлагается с выделением Н2Те.
-Sn.
Устойчив на воздухе. Порошкообразный разрушается водой. В орг. р-рителях
не раств., минеральными к-тами разлагается с выделением Н2Те.
Синтезируют ZnTe либо сплавлением компонентов
в инертной атмосфере, либо при нагр. смеси ZnO с Те и щавелевой к-той.
Монокристаллы выращивают направленной кристаллизацией расплава или вытягиванием
по Чохральскому. Используют также осаждение из газовой фазы - путем возгонки,
взаимод. паров компонентов или транспортными р-циями. Пленки получают из
газовой фазы. ZnTe - материал для фоторезисторов, приемников ИК излучения,
дозиметров и счетчиков радиоизлучения, люминофор, полупроводниковый материал,
в т. ч. в лазерах.
Лит.: Полупроводниковые халькогениды и сплавы на их основе, М., 1975; МорозоваН.К., Кузнецов В. А., Сульфид цинка. Получение и оптические свойства, М., 1987.
П. И. Федоров.

