Циглера реакции
ЦИГЛЕРА РЕАКЦИИ, 1) получение триалкилуксусных к-т алкилированием нитрилов алкилуксусных к-т с послед. гидролизом промежуточно образующихся нитрилов и амидов:
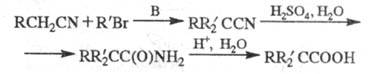
В качестве оснований (В) применяют LiNR2
или NaNH2, в качестве р-рителя - обычно диэтиловый эфир, ТГФ,
ДМФА, NH3 или глим. Алкилирующие агенты - первичные или вторичные
алкилгалогениды. В ряде случаев стадию алкилирования проводят в условиях
межфазного катализа.
Обычно к свежеприготовленному р-ру основания
добавляют р-р нитрила и затем избыточное кол-во R'Br (иногда реагенты вводят
в р-цию поочередно частями). Образовавшийся нитрил RR'2CCN обрабатывают
при т-ре ок. 100 °С конц. H2SO4, амид - смесью NaNO2
и H2SO4 или смесью C4H9ONO/CH3COOH/HC1.
Выходы 30-90%.
Механизм р-ции включает след. стадии:
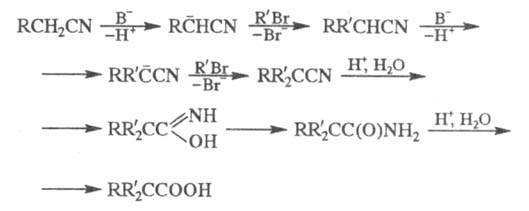
Р-цию используют в препаративных целях. Открыта К. Циглером в 1932.
Лит.: Вацуро К. В., Мишенко Г. Л., Именные реакции в органической химии, М., 1976; Mapч Д ж., Органическая химия, пер. с англ., т. 2, М., 1987, с. 206-09.
2) Получение макроциклич. кетонов циклизацией динитрилов под действием диорганиламидов щелочных металлов с послед. гидролизом и декарбоксилированием промежут. продуктов:
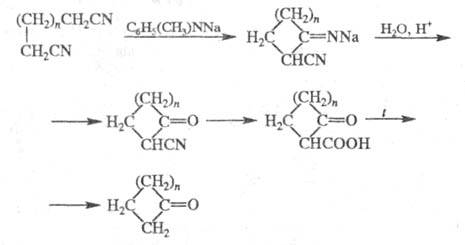
Первая стадия этой р-ции (наряду с димеризацией
нитрилов) впервые изучена Торпом, поэтому такой синтез наз. также Торпа-Циглера
реакцией.
Наиб. легко и с высоким выходом в Ц. р.
образуются циклы C5-C7, выходы циклич. кетонов С9-С13
весьма низкие (1-13%), для получения циклов С14-С33
используют спец. аппаратуру и большое разбавление (выход 60-80%). Циклы
С3-С4 этим способом получить не удается.
В р-цию вступают динитрилы, содержащие
в цепи гетеро-атомы (N, О, S), алкильные и арильные группы. В качестве
оснований обычно используют N-этиланилиды Li или Na или диалкиламиды Li,
в качестве р-рителя - диалкиловые эфиры.
Обычно динитрил медленно (от 10 до 340
ч) добавляют к кипящему р-ру амида щелочного металла; полученную смесь
обрабатывают избытком р-ра НС1 и затем добавляют конц. НС1. Образовавшийся
кетонитрил подвергают жесткому гидролизу и декарбоксилированию. Механизм
циклизации ди-нитрилов не выяснен. Ц. р. используют в препаративной практике.
Реакция открыта К. Циглером в 1933.
Лит.: Schaefer J., Bloomfield J., Organic reactions, v. 15.N.Y.-L., 1967, p. 28; Taylor E., McKillop А., в сб.: Advances in organic chemistty, v. 7, N. Y., 1970.
3) Полимеризация олефинов при низком давлении
на комплексных катализаторах (наз. также Циглера - Натты р-цией), включающих
соед. переходного металла (напр., ТiС13) и металлоорг. соед.
I-III группы периодич. системы [напр., А1(С2Н5)3].
Р-цию осуществляют при 50-70 °С, пропуская
осушенный и обескислороженный олефин через р-р комплексного катализатора
в бензине, петролейном эфире или др. инертном орг. р-рителе.
Р-ция открыта К. Циглером в 1955.
См. также Металлокомплексный катализ,
Циглера-Натты катализаторы.
Лит.: Органикум, пер. с нем., т. 2, М., 1992, с. 400; Ziegler К. [u. а.], "Angew. Chem.", 1955, Bd 67, S. 426-541; там же, 1959, Bd 71, S. 623-25.
К. Циглером также открыты и разработаны
др. р-ции:
1) синтез алкильных производных алюминия
действием на А1 олефинов и Н2 под давлением в присут. АlХ3
(X = Н, С1, R), присоединением этилена к углеводородной цепи в Alk3Al,
переалкилированием Alk3Al действием олефинов;
2) получение спиртов из олефинов (используется
в пром-сти) путем последоват. превращений:
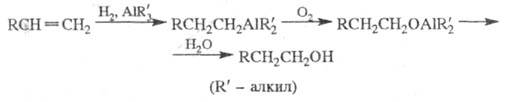
3) получение алкиллитиевых соед. действием
RHal на Li в инертном р-рителе;
4) алкилирование гетероциклич. азотсодержащих
соед. действием алкиллитиевых реагентов (иногда эту р-цию наз. алкилированием
по Циглеру), напр.:
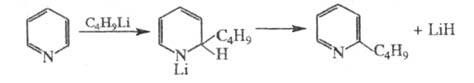
5) получение азулена по схеме:
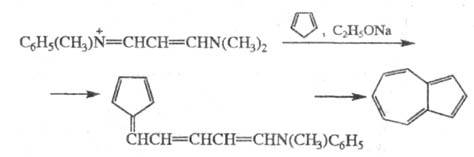
См. также Воля-Циглера реакция.
Г.И. Дрозд.

