Цинкорганические соединения
ЦИНКОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ,
содержат
связь Zn - С. Осн. типы: R2Zn, RZnR', RZnX (R и R'=Alk, Ar;
X = H, Hal, OR,
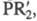
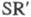 и др.). Из Ц. с. с
и др.). Из Ц. с. с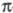 -связью
металл-лиганд известен только CH3ZnC5H5:
в газовой фазе имеет структуру с
-связью
металл-лиганд известен только CH3ZnC5H5:
в газовой фазе имеет структуру с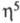 -связанным
С5Н5-лигандом, в твердой фазе -полимера с мостиковыми
С5Н5-группами, связанными по
-связанным
С5Н5-лигандом, в твердой фазе -полимера с мостиковыми
С5Н5-группами, связанными по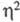 -или
-или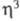 -типу.
Низшие Alk2Zn - летучие бесцв. подвижные жидкости, высшие Alk2Zn
и Ar2Zn - обычно низкоплавкие твердые в-ва, существуют в виде
мономеров, имеющих в твердом виде и в р-ре линейную структуру, раств. в
орг. р-рителях. Присутствие в алкильном радикале тройной связи приводит
к димерным твердым в-вам, плохо раств. в неполярных апротонных р-рителях.
Ц. с. типа RZnX - димеры [напр., (CH3ZnNPh2)2]
или более высокие ассоциаты [напр., (CH3ZnOCH3)4].
-типу.
Низшие Alk2Zn - летучие бесцв. подвижные жидкости, высшие Alk2Zn
и Ar2Zn - обычно низкоплавкие твердые в-ва, существуют в виде
мономеров, имеющих в твердом виде и в р-ре линейную структуру, раств. в
орг. р-рителях. Присутствие в алкильном радикале тройной связи приводит
к димерным твердым в-вам, плохо раств. в неполярных апротонных р-рителях.
Ц. с. типа RZnX - димеры [напр., (CH3ZnNPh2)2]
или более высокие ассоциаты [напр., (CH3ZnOCH3)4].
Диметилцинк термически стабилен, остальные
Alk2Zn разлагаются при нагр. с выделением металлич. Zn. Термич.
устойчивость уменьшается с увеличением длины и разветвленности R. Низшие
Alk2Zn (по С3 включительно) кинетически и термодинамически
нестабильны к окислению и гидролизу, на воздухе самовозгораются, водой
разлагаются со взрывом. Другие Ц. с. окисляются менее энергично. При осторожном
окислении Alk2Zn дают А1kOОН; р-ция идет через стадию образования
цинкорг. пероксидов. При взаимод. Alk2Zn с триалкилгалогенметанами
образуются углеводороды с четвертичным атомом С (р-ция Бутлерова-Львова):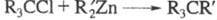 ; р-ция с хлорангидридами алифатич. к-т приводит к третичным спиртам (см.
Бутлерова
реакция). С карбонильными соед. Ц. с. реагируют подобно реактивам Гриньяра,
р-цию используют для получения вторичных и третичных спиртов (р-ция Зайцева).
Ц. с. с электронодонорными молекулами образуют устойчивые комплексы, в
к-рых атом Zn трех- или четырехкоординационен, напр. (трет-C4H9)(трет-C4H9O)Zn
пиридин. При р-ции Ph2Zn с PhLi образуются солеобразные комплексы
Li[Ph3Zn]. Ц. с. типа
; р-ция с хлорангидридами алифатич. к-т приводит к третичным спиртам (см.
Бутлерова
реакция). С карбонильными соед. Ц. с. реагируют подобно реактивам Гриньяра,
р-цию используют для получения вторичных и третичных спиртов (р-ция Зайцева).
Ц. с. с электронодонорными молекулами образуют устойчивые комплексы, в
к-рых атом Zn трех- или четырехкоординационен, напр. (трет-C4H9)(трет-C4H9O)Zn
пиридин. При р-ции Ph2Zn с PhLi образуются солеобразные комплексы
Li[Ph3Zn]. Ц. с. типа с радикалами близкой природы симметризуются:
с радикалами близкой природы симметризуются:
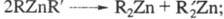 с радикалами разл. природы -устойчивы к симметризации.
с радикалами разл. природы -устойчивы к симметризации.
Получают Ц. с. чаще всего взаимод. алкилцинкгалогенидов
с реактивами Гриньяра: C2H5ZnI + C3H7MgBr C2H5ZnC3H7
C2H5ZnC3H7 (C2H5)2Zn + (C3H7)2Zn.
Используют также прямой метод - р-цию алкилбромидов или иодидов с металлич.
Zn, активированным др. металлами или диспергированием: 2RI + 2Zn
(C2H5)2Zn + (C3H7)2Zn.
Используют также прямой метод - р-цию алкилбромидов или иодидов с металлич.
Zn, активированным др. металлами или диспергированием: 2RI + 2Zn 2RZnI
2RZnI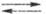 R2Zn
+ ZnI2. Ц. с., свободные от галогенидов Zn, получают трансметаллированием:
R2Hg + Zn
R2Zn
+ ZnI2. Ц. с., свободные от галогенидов Zn, получают трансметаллированием:
R2Hg + Zn R2Zn
+ Hg. Известны др. методы синтеза Ц. с., напр.:
R2Zn
+ Hg. Известны др. методы синтеза Ц. с., напр.:
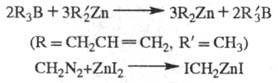
Применяют Ц. с. в орг. синтезе (как правило, в виде р-ров). Комплексы Ц. с. с галогенидами переходных металлов - катализаторы полимеризации непредельных соед.
Лит.: Методы элементоорганической химии. Цинк, кадмий, под ред. А. Н. Несмеянова, К. А. Кочешкова, т. 3, М., 1964; Comprehensive organometallic chemistry, v. 2, Oxf.- [a.o.], 1982, p. 823-62.
А. С. Перегудов.

