Цитохром с-оксидаза
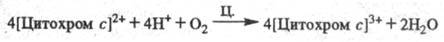
Окисление цитохрома с
сопровождается
появлением мембранного протонного потенциала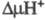 , к-рый используется клеткой для обеспечения всех видов работ, выполняемых
биомембранами, и в первую очередь для синтеза АТФ. Фермент широко распространен
как среди эукариот, так и среди прокариот. У эукариот фермент расположен
во внутр. мембране митохондрий, у прокариот - в цитоплазматич. мембране.
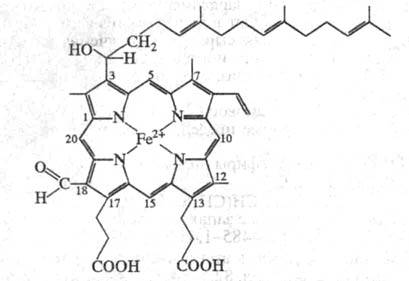
Ц.- сложный белок, состоящий из неск. полипептидных цепей, связанных с
4 окислит.-восстановит. центрами, 2 ионами Си2+ и 2 гемами а
(см. ф-лу).
, к-рый используется клеткой для обеспечения всех видов работ, выполняемых
биомембранами, и в первую очередь для синтеза АТФ. Фермент широко распространен
как среди эукариот, так и среди прокариот. У эукариот фермент расположен
во внутр. мембране митохондрий, у прокариот - в цитоплазматич. мембране.
Ц.- сложный белок, состоящий из неск. полипептидных цепей, связанных с
4 окислит.-восстановит. центрами, 2 ионами Си2+ и 2 гемами а
(см. ф-лу).
Мол. масса фермента (напр., Ц. из сердца
быка) составляет от 180 до 200 тыс. Ц. обычно существует в димерной форме
и прочно ассоциирована с молекулами фосфолипидов мембран и ПАВ, использованных
при ее выделении. Ц. имеет характерный спектр поглощения;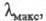 нм (
нм (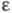 -10-3):
восстановленная форма 443 (107), 603 (23,2); окисленная форма -421 (82),
598 (11).
-10-3):
восстановленная форма 443 (107), 603 (23,2); окисленная форма -421 (82),
598 (11).
Железо гемов может находиться в окисленном
или восстановленном состоянии и образует координац. связи с одним либо
двумя аминокислотными остатками белковой цепи. В зависимости от белкового
окружения гемы различаются по св-вам: один (гем а3
),
высокоспиновый, после восстановления реагирует с О2 или СО,
CN. Другой (гем а), низкоспиновый, в такие р-ции не вступает. Ионы
меди в Ц. также неравноценны. Один из них, СuА, дает сигнал
в спектре ЭПР и взаимод. с гемом a, другой, Сuв, не дает
сигналов, взаимод. с гемом а3. Число полипептидных цепей
в ферменте зависит от эволюционной ступени, занимаемой организмом - источником
Ц. Фермент прокариот включает 2-3 белковые цепи, эукариоты содержат Ц.
из 5 (соя, батат) или 7-8 субъединиц (дрожжи). У млекопитающих число субъединиц
фермента возрастает до 12-13. Все полипептиды в Ц. различны по структуре
и имеют мол. м. от 5 до 57 тыс. Три наиб. крупные субъединицы (I-III; рис.).
Ц. эукариот кодируются в митохондриальном геноме и синтезируются на митохондриальных
рибосомах. Эти субъединицы играют главную роль в выполнении биол. ф-ций
Ц. Они связаны со всеми окислит.-восстановит. центрами и имеют участки
узнавания цитохрома с. Остальные субъединицы Ц. кодируются в ядерном
геноме и синтезируются в цитоплазме. Ф-ции этих полипептидов, вероятно,
связаны с регуляцией активности Ц. и могут отражать также тканевую специфичность
фермента. Первичная структура полипептидов наиб. изученных ферментов (бык,
крыса, Saccharomyces cerevisiae)полностью известна.
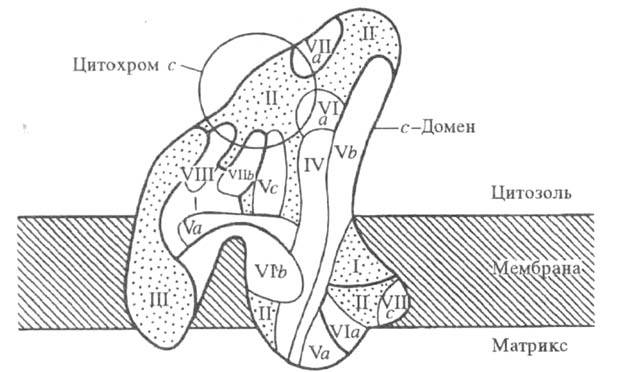
Модель структурной н функциональной организации
полипептидов в цитохромоксидазе из печени крысы. Римскими цифрами и буквами
обозначены отдельные субъединицы фермента.
Ц.- мембранный фермент. с-Домен фермента
выступает из плоскости мембраны с цитоплазматич. стороны на 0,50-0,55 нм;
с матричной стороны выступают на 0,15-0,25 нм два домена, к-рые состоят
из спирализованных участков полипептидных цепей и включают 8-12 и 5-8 спиралей,
соотв.
Цитохром с взаимод. с Ц., связываясь
с субъединицей П. Цепочка, по к-рой электроны передаются к кислороду, м.
б. представлена схемой: Цитохром с СuА
СuА Гем
а
Гем
а Гем
а3-СuВ + О2. Перенос
электрона сопровождается трансмембранным переносом двух протонов из матрикса
в цитозольное пространство и появлением
Гем
а3-СuВ + О2. Перенос
электрона сопровождается трансмембранным переносом двух протонов из матрикса
в цитозольное пространство и появлением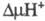 .
Такой механизм позволяет отнести Ц. к мембранным протонным насосам.
.
Такой механизм позволяет отнести Ц. к мембранным протонным насосам.
Для выделения Ц. из митохондрий или субмитохондриальных
частиц используют ПАВ, чаще всего холат или дезоксихолат натрия. Обычно
чистоту Ц. выражают через отношение содержания гема а
к кол-ву белка.
Для препаратов фермента, выделенных разл. способами, этот показатель составляет
8-14 нмоль/мг. Определить точное значение этой величины пока невозможно
из-за отсутствия надежных данных о числе субъединиц, действительно необходимых
для функционирования фермента.
Важная характеристика Ц.- ферментативная
активность, к-рая определяется спектрофотометрически (по уменьшению поглощения
ферроцитохрома с) либо полярографически (по изменению концентрации
О2 в среде); она может достигать 400 моль цитохрома с на
моль Ц. в секунду. Активность фермента сильно зависит от кол-ва липидов
в препарате. При тщательном удалении липидов ферментативная активность
резко снижается, но после добавления липидов частично восстанавливается.
Ц. необходима для обеспечения жизнедеятельности
всех эукариотич. и нек-рых прокариотич. клеток. Нарушение биосинтеза Ц.
в клетках человека приводит к их гибели. Структурные и функциональные изменения
фермента являются причиной серьезных заболеваний.
Лит.: Филатов И. А. [и др.], "Биоорг. химия", 1988, т. 14, № 6, с. 725-45; Wikstrom М., Кrаb К., Saraste M., Cytochrome oxidase. A synthesis, L., 1981.
М. А. Кулиш.

