Цинк
Содержание Ц. в земной коре 7-10-3 % по массе, в воде морей и океанов 0,01 мг/л. Известно более 70 минералов Ц., из них важнейшие: сфалерит (цинковая обманка) - кубич. модификация ZnS, его светлая разновидность - клейофан, черная - марматит; вюрцит (вюртцит) - гексагон. модификация ZnS; смитсонит ZnCO3; каламин Zn4(OH)2Si2O7 хH2O; цинкит ZnO; виллемит Zn2SiO4; франклинит ZnFe2O4. Минералы Ц. обычно ассоциируются с минералами Рb и Сu в полиметаллич. рудах. Постоянные спутники Ц. в рудах -рассеянные элементы - Cd, In, а также Ge, Ga, Tl.
Свойства. Ц.- голубовато-белый металл.
Кристаллич. решетка гексагон. плотноупакованная, а - 0,26649 нм,
с = 0,49468 нм, z = 2, пространств. группа С6/mmm;
т. пл. 419,58 °С, т. кип. 906,2 oС; плотн. 7,133 г/см3;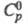 25,4 Дж/(моль х К);
25,4 Дж/(моль х К); 7,2 кДж/моль,
7,2 кДж/моль,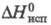 115,3
кДж/моль,
115,3
кДж/моль,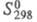 41,6 Дж/(моль х К); ур-ния температурной зависимости давления пара: lg
p
(мм рт.ст.) = 10,084 —6910/T + 0,192 lg Т+ 0,524 x 10-2
(298 - 692,7К), lg p (мм рт. ст.) = 8,242 - 6294/T -
0,015 lg Т (692,7 - 1164К); температурный коэф. линейного расширения
25,0 x 10-6 (273 - 373К); теплопроводность 116,0 Вт/(м x К);
r 5,92 мкОм
x см, температурный коэф. r
3,7 x 10-3К-1 (298-398К). Ниже 0,825 К Ц.-сверхпроводник.
Диамагнитен, магн. восприимчивость -0,175 x 10-9. Модуль упругости
Ц. 99,2 ГПа (293К);
41,6 Дж/(моль х К); ур-ния температурной зависимости давления пара: lg
p
(мм рт.ст.) = 10,084 —6910/T + 0,192 lg Т+ 0,524 x 10-2
(298 - 692,7К), lg p (мм рт. ст.) = 8,242 - 6294/T -
0,015 lg Т (692,7 - 1164К); температурный коэф. линейного расширения
25,0 x 10-6 (273 - 373К); теплопроводность 116,0 Вт/(м x К);
r 5,92 мкОм
x см, температурный коэф. r
3,7 x 10-3К-1 (298-398К). Ниже 0,825 К Ц.-сверхпроводник.
Диамагнитен, магн. восприимчивость -0,175 x 10-9. Модуль упругости
Ц. 99,2 ГПа (293К); 70-100 МПа; относит, удлинение 20-60%; твердость по Бринеллю для отожженного
образца 412 МПа. При комнатной т-ре Ц. хрупок, при 100-150 °С становится
пластичным и прокатывается в тонкие листы и проволоку, при 200-250 °С становится
очень хрупок, м. б. истолчен в порошок.
70-100 МПа; относит, удлинение 20-60%; твердость по Бринеллю для отожженного
образца 412 МПа. При комнатной т-ре Ц. хрупок, при 100-150 °С становится
пластичным и прокатывается в тонкие листы и проволоку, при 200-250 °С становится
очень хрупок, м. б. истолчен в порошок.
ХАРАКТЕРИСТИКА НЕКОТОРЫХ СОЕДИНЕНИЙ
ЦИНКА
|
Показатель
|
Zn3P2
|
ZnSb
|
ZnAl2O3
|
Zn[B2O3(OH)5]
x H2O
|
ZnCO3
|
Zn2SiO4
|
Zn3(PO4)2
|
Zn3(AsO4)2
х 4Н2O
|
ZnWO4
|
|
Цвет
|
Серо-стальной
|
Серый
|
Зеленый
|
Бесцв.
|
Бесцв.
|
Бесцв.
|
Бесцв.
|
Бесцв.
|
Бесцв.
|
|
Сингония
|
Тетрагон.
а
|
Ромбич.
|
Кубич.
|
Ромбич.
|
Тригон.
|
Тригон.
|
Моноклинная
в
|
Триклинная
г
|
Моноклинная
д
|
|
Параметры решетки,
нм: а
|
0,8097
|
0,6212
|
0,80883
|
0,755
|
0,465
|
1,394
|
0,814
|
0,599
|
0,469
|
|
b
|
_
|
0,7741
|
_
|
0,895
|
-
|
-
|
0,563
|
0,763
|
0,574
|
|
с
|
1,145
|
0,8115
|
—
|
1,010
|
1,503
|
0,9309
|
1,504
|
0,543
|
0,496
|
|
Число формуль-ных
единиц в ячейке
|
-
|
8
|
8
|
4
|
6
|
18
|
4
|
1
|
2
|
|
Пространств/
группа
|
Р42птс
|
Рbса
|
Fd3m
|
Рпта
|
R3с
|
R3
|
С2/с
|
—
|
Р2/с
|
|
Т пл., °С
|
1193
|
546
|
1950б
|
—
|
—
|
1512
|
1060
|
—
|
1200
|
|
Плотн., г/см3
|
4,54
|
6,36
|
4,58
|
2,44
|
4,40
|
4,103
|
4,0
|
3,79
|
7,79
|
|
Сор,Дж/(моль
х К)
|
—
|
—
|
—
|
—
|
80,1
|
123,3
|
—
|
-
|
126
|
|
DHообр,
кДж/моль
|
190,6
|
-16,8
|
-2067
|
—
|
-818
|
-1641
|
-2900
|
—
|
-1230,6
|
|
S°298,Дж/(молль
х К)
|
—
|
—
|
—
|
—
|
82,4
|
131,4
|
—
|
—
|
129,9
|
а Т-ра
полиморфного перехода 880 оС. б Т-ра разложения.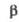 =
105,13°. При 940 °С переходит в другую моноклинную форму.
=
105,13°. При 940 °С переходит в другую моноклинную форму.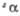 =
94,18°,
=
94,18°,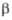 =
91,12е,
=
91,12е,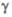 =
92,6°.
=
92,6°.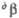 = 89,5°.
= 89,5°.
Стандартный электродный потенциал Ц. -0,76
В. Компактный Ц. тускнеет на воздухе, покрываясь тонким слоем
цинка
оксида, влажный воздух, особенно в присут. СО2, постепенно
разрушает Ц. при комнатной т-ре. При сильном нагр. на воздухе Ц. сгорает
с образованием ZnO. Пары воды при красном калении реагируют с Ц. с выделением
Н2. Ц. обычной чистоты легко взаимод. с к-тами с образованием
солей и с р-рами щелочей с образованием гидроцинкатов, напр. Na2[Zn(OH)4],
раств. в р-рах NH3 и солей аммония, FеС13, вытесняет
Сu, Cd и др. более электроположит. металлы из р-ров их солей. Ц. высокой
чистоты почти не реагирует ни с к-тами, ни с р-рами щелочей. Ц. не взаимод.
с Н2, но Н2 незначительно раств. в Ц. при повышенных
т-рах. Электролитич. Ц. может содержать до 1 см3 Н2
на 1 г металла. Гидрид ZnH2 получают косвенными методами, напр.
действием LiA1H4 на Zn(CH3)2 в диэтиловом
эфире; устойчив в отсутствие влаги, медленно разлагается водой, быстро
- к-тами; не раств. в эфире. С N2 Ц. не реагирует, с NH3
при 550-600 °С образует нитрид Zn3N2, к-рый устойчив
на воздухе, разлагается водой.
С галогенами выше т-ры плавления (в присут.
паров воды -при комнатной т-ре) Ц. образует цинка галогениды, с халько-генами
при нагр.- цинка халькогениды. Кипящий Ц. растворяет незначит. кол-во
углерода. Сообщения о синтезе карбида действием ацетилена на Ц. не подтвердились,
но получены тройные карбиды, напр. Ni3ZnC. Растворимость Si
в металлич. Ц. 0,06% при 600 °С и увеличивается с ростом т-ры. Силициды
Ц., как и бориды, неизвестны. В расплавленном Ц. растворяется до 15% Р.
При действии паров Р на Ц. при нагр. образуются фосфиды Zn3P2
и ZnP2. Получены арсениды аналогичного состава, при сплавлении
c Sb - антимониды Zn3Sb2, Zn4Sb3
и ZnSb. Все соед. Ц. с Р, As и Sb -полупроводники.
Соли Ц. бесцветны, если не содержат окрашенных
анионов. В р-рах они сильно диссоциированы, р-ры имеют кислую р-цию вследствие
гидролиза. При действии р-ров щелочей и NH3 осаждаются, начиная
с рН~5, гидроксосоли, напр. Zn2(OH)2SO4,
переходящие в гидроксид Zn(OH)2, к-рый раств. в избытке осадителя.
Для Ц. характерны комплексы с NH3.
Сухие соли Ц. поглощают до 6 молекул NH3. Гидроксид и соли Ц.
раств. в р-рах NH3 с образованием комплексных катионов, содержащих
от 1 до 6 молекул NH3. Комплексные аммиакаты хорошо раств. в
воде, из р-ров в кристаллич. виде выделены гл. обр. [Zn(NH3)2]X2
и [Zn(NH3)4]X2. Труднорастворимый цианид
Zn(CN)2 с избытком цианидов щелочных металлов образует легко
р-римые комплексы M2[Zn(CN)4] и M[Zn(CN)3],
сульфит - комплексы M2[Zn(SO3)2]. Хорошо
растворимые в воде тиосульфат и тиоцианат Ц. дают соотв. комплексы [Zn(S203)2]2-
и [Zn(SCN)4]2-.
Фосфид Zn3P2 (табл.)
разлагается горячей водой и к-тами с выделением РН3; зооцид
(родентицид). Антимонид ZnSb - полупроводник с шириной запрещенной зоны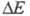 0,61 эВ; в воде и орг. р-рителях не раств., медленно реагирует с минеральными
к-тами; монокристаллы выращивают направленной кристаллизацией, зонной плавкой
или вытягиванием по Чохральскому; материал для термоэлектрич. генераторов.
0,61 эВ; в воде и орг. р-рителях не раств., медленно реагирует с минеральными
к-тами; монокристаллы выращивают направленной кристаллизацией, зонной плавкой
или вытягиванием по Чохральскому; материал для термоэлектрич. генераторов.
Кобальтат (зелень Ринмана) состава от
ZnCo2O4 до ZnCoO2 - зеленые кристаллы
со структурой типа шпинели; получают спеканием оксидов или прокаливанием
совместно осажденных гидроксокарбонатов; пигмент для керамики. Борат Zn[B2O3(OH)5]
x H2O при нагр. обезвоживается до Zn2B6O11,
к-рый разлагается при 610о С; получают взаимод. Н3ВО3
с гидроксидом или гидроксокарбонатом Ц.; борат и его гидраты - антипирены
для тканей и бумаги, пигменты в лакокрасочных покрытиях, компоненты люминофоров,
флюсов для пайки и сварки металлов.
Карбонат ZnCO3 разлагается
выше ~ 150 °С; практически не раств. в воде (5,7 х 10-5 по массе)
и в орг. р-рителях, при кипячении с водой переходит в гидроксокарбонат;
легко раств. в к-тах, р-рах щелочей и солей аммония; получают действием
на р-р ZnSO4 р-ром КНСО3, насыщенным СО2,
с длительной выдержкой на холоде; в природе - минерал смитсонит. Гидроксокарбонат
имеет переменный состав, выделены Zn2(OH)2CO3
х
2H2O, Zn4(OH)6CO3 хnH2O,
Zn5(OH)6(CO3)2 (минерал гидроцинкит)
и др.; р-римость в воде ~ 1 х 10-3 % по массе; при 140 °С разлагается;
получают действием Na2CO3 на р-р ZnSO4
при кипячении. Карбонаты используют для получения др. соединений Ц.
Ортосиликат Zn2SiO4
не раств. в воде и орг. р-рителях, раств. в 20%-ной HF, разлагается соляной
к-той; получают взаимод. S1C14 или SiF4 с ZnO, обжигом
смеси SiO2, ZnCl2 и NaCl в присут. паров воды, гидротермальным
синтезом из ZnO и SiO2 в содовых р-рах; в природе - минерал
виллемит; люминофор.
Ортофосфат Zn3(PO4)2
из водных р-ров кристаллизуется в виде тетрагидрата; не раств. в воде и
орг. р-рителях, раств. в разб. к-тах, р-рах щелочей и NH3; при
110 °С теряет 2 молекулы воды, при 210 °С полностью обезвоживается; получают
взаимод. р-ров ZnSO4 и Nа2НРО4 или растворением
ZnO в Н3РО4, безводный - взаимод. ZnO с (NH4)2HPO4;
тетрагидрат - в природе минерал гопеит; компонент композиционных и смазочных
материалов, катализаторов орг. синтеза, антикоррозионных пигментов, люминофоров,
цинковых удобрений. Ортоарсенат Zn3(AsO4)2 x
4Н2О при 150 °С переходит в моногидрат, при 290 o
С обезвоживается; известен также октагидрат - в природе минерал кёттигит;
не раств. в воде и орг. р-рителях, раств. в к-тах, р-рах щелочей и NH3;
получают взаимод. р-ров ZnSO4 и Na2HAsO4;
антисептик для древесины, инсектицид, компонент необрастающих красок. Стеарат
(C17H35COO)2Zn, т. пл. 130 °С; не раств.
в воде, этаноле, диэтиловом эфире; вспомогат. сиккатив, загуститель смазок,
компонент косметич. кремов, пудры и др.
См. также Цинка ацетат, Цинка сульфат,
Цинка хлорид, Цинкорганические соединения.
Получение. Исходное сырье в произ-ве Ц.-
сульфидные цинковые и полиметаллич. руды. Используют как гидрометаллургич.,
так и пирометаллургич. методы получения Ц. Гидрометаллургически получают
85% всего Ц. Цинковые концентраты после флотационного обогащения для удаления
S обжигают в печах кипящего слоя или во взвешенном состоянии. Огарок выщелачивают
содержащим H2SO4 отработанным электролитом (см. ниже).
Полученный р-р ZnSO4 тщательно очищают от Fe обработкой ZnO
или избытком исходного огарка (стадия "нейтрального выщелачивания"). Вместе
с Fe соосаждаются As, Sb, Al, In, Ga и др. Примеси Сu и Cd, а также Ni
удаляют действием цинковой пыли с получением т. наз. медно-кадмиевого кека.
Примесь Со удаляют осаждением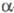 -нитрозо-
-нитрозо-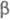 -нафтолом
либо этилксантогенатом Na или К. Для удаления хлора используют либо Ag2SO4,
либо CuSO4 и цинковую пыль.
-нафтолом
либо этилксантогенатом Na или К. Для удаления хлора используют либо Ag2SO4,
либо CuSO4 и цинковую пыль.
Из очищенного р-ра Ц. осаждают электролитически
на алюминиевых катодах. Отработанный электролит возвращают на выщелачивание.
Остатки от выщелачивания ("цинковые кеки") обычно содержат значит. кол-ва
Ц. в виде малорастворимых соед., напр. феррита, а также Рb и др. металлы.
Эти кеки либо дополнительно выщелачивают более крепкой H2SO4,
либо подвергают вельцеванию - обжигу вместе с коксиком в барабанных вращающихся
печах при ~ 1200 °С, в результате чего образуются возгоны оксидов Zn и
Рb -"вельц-оксиды". Эти возгоны перерабатывают гидрометаллургически, подобно
вышеописанному, в отдельной технол. ветви с попутным выделением концентрата
In и др. редких элементов.
Пирометаллургич. произ-во Ц. также начинают
окислит. обжигом, но с получением кускового материала - либо обжигом на
ленточной агломерационной машине, либо спеканием порошкообразного огарка.
Агломерат в смеси с углем или коксом восстанавливают при т-ре выше т-ры
кипения Ц. Для этой цели используют либо ретортные печи (при этом Ц. отгоняется,
но шихта полностью не расплавляется), либо шахтные или электрич. рудно-термич.
печи, в к-рых шихта полностью расплавляется. Во всех случаях пары металлич.
Ц. конденсируются. наиб. летучая фракция, обогащенная Cd,-т. наз. пуссьера
- собирается отдельно и перерабатывается для извлечения Cd. Твердые остатки
в ретортных печах - "раймовки" - перерабатываются дальше путем, напр.,
вельцевания.
Для очистки Ц. применяют ликвацию (отделение
Рb и Fe), двухступенчатую ректификацию (отделение Рb и Cd, а также Сu,
Fe и пр.) и хим. методы, в частности удаление Рb действием металлич. Na
и удаление Fe действием А1 под слоем флюса. Ц., полученный гидрометаллургич.
путем, переплавляют с добавлением флюса NH4Cl, что способствует
удалению Т1 и др.
Для получения Ц. высокой чистоты используют
дистилляцию в инертной атмосфере или в вакууме, ректификацию и зонную перекристаллизацию
в атмосфере Аr. Предложены методы электролитич. рафинирования, в частности
с амальгамными электродами.
Определение. При систематич. анализе Ц. попадает в группу сульфида аммония. Качественно Ц. обнаруживают по р-ции с (NH4)2[Hg(SCN)4] - в присут. ионов Сu образуется фиолетовый, в присут. ионов Со - синий осадок. Применяют также р-цию с дитизоном (красное окрашивание), метиловым фиолетовым (синее окрашивание или фиолетовый осадок в присут. NH4SCN) и др. Удобно спектральное определение Ц. по группе из трех линий 334,502, 334,557 и 334,593 нм или по двум линиям 330,259 и 330,294 нм. Количественно Ц. определяют гравиметрически осаждением в виде NH4ZnPO4 с послед. прокаливанием до Zn2P2O7, осаждением Zn[Hg(SCN)4] или гидрооксихинолината Ц. Но чаще используют титриметрич. методы - титрование комплексоном III в кислой или щелочной среде с индикаторами эриохром черный Т (рН 10), мурексид, ксиленоловый оранжевый, дитизон (рН 4—5) и т. д. Для определения малых кол-в Ц. применяют фотометрич. метод, в частности с использованием дитизона. Применяют полярографич. метод, амперометрич. и потенциометрич. титрование (напр., ферроцианидом К), эмиссионный спектральный, атомно-абсороционный и др.
Применение. Осн. область использования
- антикоррозионные покрытия (цинкование) железа и стали. Листы металлич.
Ц. применяют в аккумуляторах и сухих элементах, в типографском деле. Ц.
используют в металлургии при рафинировании Рb от Ag и Аu; цинковую пыль
- для выделения Cd, In, Au и т. п. из р-ров цементацией. Ц. в соляной к-те
и цинковая пыль - восстановители в орг. синтезе. Широко применяют
цинка
сплавы, расходуется Ц. также на произ-во разл. соед., в частности пигментов
(цинковые белила). Примерное распределение Ц. по областям использования
(в %) -цинкование и покрытия сплавами Ц. - 45; хим. источники тока - 20;
латуни и бронзы - 15; сплавы на основе Ц. - 12; пигменты и пр.- 8.
Объем мирового произ-ва Ц. (без СССР)
5,22 млн. т (1989). Осн. производители - Канада, Япония, США, Германия,
Бельгия, Франция, Австралия.
Ц. в небольших кол-вах необходим для жизнедеятельности
растений (см. Цинковые удобрения), животных и человека, т. к. входит
в состав нек-рых ферментов и гормонов. Потребность человека в Ц. 15 мг
в сут.
Металлич. Ц. малотоксичен, но хранить
продукты в цинковой посуде не рекомендуется. Нек-рые соед., в частности
оксид, фосфид, токсичны. Пары ZnO, а также цинковая пыль вызывают т. наз.
литейную лихорадку (симптомы - озноб, ломота и боль в мышцах, головная
боль, тошнота и кашель). Р-римые соли Ц. вызывают расстройство пищеварения,
раздражение слизистых оболочек. В воздухе рабочей зоны ПДК ZnO 0,5 мг/м3,
временно допустимая доза ZnCO3 и ZnSе 2,0 мг/м3,
фосфатов и нитрата 0,5 мг/м3, ПДК в воде для Ц. 1,0 мг/л, в
водоемах для разведения рыб 0,01 мг/л, в почве 23,0 мг/кг. ПДК Ц. в продуктах
питания, мг/кг: рыбных , мясных 20,0, молочных 5,0, хлебе, зерне
25,0, овощах, фруктах, соках 10,0. Цинковая пыль пирофорна.
Сплавы Ц. (латунь) были известны с глубокой
древнос (2400-2000 до н.э.). Получение Ц. описал Страбон (1 в. д. н. э.).
Пром. произ-во Ц. в Европе началось в 1743, в Китае на 400 лет раньше.
Лит.: Лакерник М.М., Пахомов а Г. Н., Металлургия ЦИНКА и кад мия, М., 1969; Живописцев В.П., Селезнева Е. А., Аналитическая химия цинка, М., 1975; Зайцев В.Я., Маргулис Е. В., Металлургия свин ца и цинка, М., 1985; Ауlett В. J., в кн.: Comprehensive inorganic chemistry, v. 3, Oxf.- [a.o.l, 1973, p. 187-253.
П.И. Федоров.

