Натрий
НАТРИЙ (от араб.
натрун, греч. nitron - природная сода; лат. Natrium) Na, хим. элемент I гр.
периодич. системы, ат. н. 11, ат.м. 22,98977; относится к щелочным металлам.
В природе один стабильный изотоп 23Na. Поперечное сечение захвата
тепловых нейтронов 4,90.10-25 м2. Конфигурация
внеш. электронной оболочки 3s1; степень окисления +1; энергии ионизации
Na0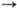 Na+
Na+  Na2+
5,13915 и 47,304 эВ; сродство к электрону 0,34 эВ; электроотрицательность по
Полингу 1,0; ат. радиус 0,192 нм, ионный радиус 0,116 нм (координац. число 6),
0,153 нм (12).
Na2+
5,13915 и 47,304 эВ; сродство к электрону 0,34 эВ; электроотрицательность по
Полингу 1,0; ат. радиус 0,192 нм, ионный радиус 0,116 нм (координац. число 6),
0,153 нм (12).
Содержание Н. в земной
коре 2,64% по массе. В гидросфере Н. содержится в виде растворимых солей в кол-ве
ок. 2,9% (при общей концентрации солей в морской воде 3,5-3,7%); содержание
Н. в морской воде 1,5.1016 т. Наличие Н. установлено в
атмосфере Солнца и межзвездном пространстве. В природе Н. находится только в
виде солей. Важнейшие минералы-галит (каменная соль) NaCl, мирабилит (глауберова
соль) Na2SO4•10 Н2О, тенардит Na,SO4,
чилийская селитра NaNO3, криолит Na3[AlF6],
трона NaHCO3•Na2CO3•2Н2О, бура (тинкал)
Na2B4O7•10Н2О, а также прир. силикаты,
напр. альбит Na[AlSi3O8], нефелин Na [AlSiO4],
содержащие помимо Н. и др. элементы. Соед. Н. входят в состав живых организмов,
гл. обр. в виде NaCl.
Так, напр., в плазме крови
человека содержание ионов Н. 0,32% по массе, в костях-0,6%, в мышечных тканях-0,6-1,5%.
Для восполнения естеств. убыли Н. из организма человек ежедневно должен употреблять
с пищей 4-5 г NaCl.
Свойства. Н.-серебристо-белый
металл, в тонких слоях с фиолетовым оттенком. Выше — 222 °С устойчива модификация
с кубич. решеткой (а = 0,4291 нм, z = 2, пространств. группа ImЗт);
при —222 °С она переходит в гексагoн. форму (а = 0,3767 нм, с
= 0,6154 нм, z = 2, пространств. группа Р63/ттс).
Т.пл. 97,86 °С, т. кип. 883,15 °С; плотн. 0,96842 г/см3
(19,7°С), ур-ния температурной зависимости плотности: d = 0,9725
- 20,11•10-4t - 1,5.10-7t2
г/см3 (0-96,6°С), d= 0,9501 -2,2976.10-4t-
1,460.10-8t2+ + 5,638.10-12t3
г/см3 (98 - 1370 °С); C0p
28,23 Дж/(моль.К), для газа 20,79 ДжДмоль•К);DH0пл
2,6 кДж/моль, DH0кип88,99 кДж/моль, DH0возг
107,5 кДж/моль (298,15 К); S0298 51,30 Дж/(моль.К),
для газа S0298 153,61 Дж/(моль.К); tкрит
2733 К, pкрит40,8 МПа, uкрит 0,128 см3/моль;
давление насыщ. пара (Па) 1,544.10-5 (371,02 К), 1,852.10-4
(400 К), 9,326.10-2 (500 К), 5,673 (600 К), 103,9 (700
К). В газообразном состоянии Н. состоит из частиц Na и Na2, содержание
Na2 (DH0обр для газа 142,3 кДж/моль)
увеличивается с ростом т-ры: 0,8% (600 К), 1,3% (650 К), 2,5% (750 К).
Ур-ния температурной зависимости:
линейного расширения твердого Н. l = l0(1 + 6,893•10-5t
+0,63.10-7t2)м; объемного расширения
жидкого Н. u = u0(l +2,4183 х х 10-4t+
7,385.10-8t2 + 15,64.10-12t3)
м3; теплопроводности твердого Н. К = 135,6 - 0,167t
Вт/(м.К) (0 - 97 °С), жидкого К = 93,0- 5,81.10-2t
Вт/(м.К) (98-1370°С); r = 4,290 + 1,993.10-2t
+ 9,848•10-6t2 мкОм.см (0-97°С.
твердый Н.), r = 7,756 + 2,054.10-2t + 3,481•10-5t2
мкО.см (98-1100°С, жидкий Н.); h (Па.с) 6,80.10-4
(100°С), 2,84.10-4 (400°С), 1,49.10-4
(883,15°С), lgh(Пa х х с) = -4,6814 - 0,4296 lg Т + 234,65T(98
- 500 °С); g (Н/м) 0,192 (97,86 °С), 0,161 (400 0С), 0,113
(883,15 °С), для жидкого g = 0,202 -1.10-4t
Н/м. Н. парамагнитен, магн. восприимчивость + 0,70.10-9
(293 К). Норм. электродный потенциал -2,714 В, в расплаве -2,4 В.
Хим. активность Н. весьма
высока. На воздухе он активно окисляется с пов-сти, в жидком состоянии выше
200 0С загорается. В зависимости от условий Н. может окисляться до
натрия оксида Na2O или пероксида Na,O2. Энергично
реагирует с водой с образованием натрия гидроксида NaOH и выделением
Н2, при большой пов-сти контакта р-ция идет со взрывом. Н. воспламеняется
в атмосфере F2, в Сl2 горит при обычной т-ре, с Вr2
реагирует лишь при нагр., с I2 в обычных условиях не реагирует. Энергично
взаимод. с S, Se и Те, образуя халькогениды составов Na2X, NaX, NaX2,
Na2X5. Благородные газы незначительно раств. в твердом
и жидком Н., при 200 °С Н. начинает поглощать Н2, образуя весьма
гигроскопичный гидрид NaH. С N2 в электрич. разряде дает нитрид Na3N
или азид NaN3, с разб. к-тами-соли. В жидком NH3 Н. легко
раств., образуя р-р синего цвета с металлич. проводимостью, содержащий катионы
Na+ и сольватированные электроны; р-римость Н. (г в 100 г NH3):
34,6 (0°С), 31,9 (-50°С), 29,4 (-105°С). Взаимод. Н. с NH3
при 300-400 °С или в присут. катализатора при охлаждении до — 30 °С
получают амид NaNH2.
При 800-900 °С газообразный
Н. с С образует карбид (ацетиленид) Na2C2. Р-цией Н. с
ацетиленом при 98 oС получают NaC=CH и этилен, при более высоких
т-рах-Na2C2. С графитом Н. образует соед. включения (см.
Графита соединения). Об орг. соединениях Н. см. в ст. Натрийорганические
соединения. Диспергированный Н. реагирует с большинством галогенидов, с
органическими (типа СН2Сl2, СНСl3)-со взрывом,
с галогенидами металлов МНаln- восстанавливая катион М2+
. Дает интерметал-лиды с Ag, Au, Cd, Ga, Tl, Sn, Pb, Sb, Bi, K, Cs; не образует
соед. с Ва, Sr, Mg, Li, Zn, Al. Co ртутью Н. образует амальгамы - интерметаллиды
состава NaHg2, NaHg4, NaHg8, NaHg, Na3Hg2,
Na5Hg2, Na3Hg. Наиб. значение имеют жидкие
амальгамы (содержат менее 2,5% по массе Н.),
образующиеся при постепенном введении Н. в Hg, находящуюся под слоем керосина
или минер. масла.
Наиб. важным соед. Н. посвящены
ст. Натрия алюминаты, Натрия бораты, Натрия карбонат, Натрия сульфат, Натрия
хлорид и др.
Получение. Н. получают:
электролизом расплава NaCl (одновременно производят Сl2) с добавками
КСl, NaF или СаСl2 для снижения т-ры плавления электролита; электролизом
расплава NaOH; небольшие кол-ва-разложением азида 2NaN3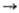 2Na
+ 3N2 и др. Электролиз NaCl проводят в электролизерах с диафрагмой;
аноды изготовлены из графита, катоды-из Сu или Fe. Очищают Н. от примесей хлоридов,
оксидов, Са, С добавлением в расплавленный Н. смеси NaOH -Na2CO3-
NaCl или Na2O2, обработкой расплава металлич. Li, Ti или
сплавом Ti-Zr, низшими хлоридами TiCl3, TiCl2, вакуумной
дистилляцией.
2Na
+ 3N2 и др. Электролиз NaCl проводят в электролизерах с диафрагмой;
аноды изготовлены из графита, катоды-из Сu или Fe. Очищают Н. от примесей хлоридов,
оксидов, Са, С добавлением в расплавленный Н. смеси NaOH -Na2CO3-
NaCl или Na2O2, обработкой расплава металлич. Li, Ti или
сплавом Ti-Zr, низшими хлоридами TiCl3, TiCl2, вакуумной
дистилляцией.
Определение. Качественно
Н. обнаруживают по характерной желтой окраске пламени его летучими соед. и по
наиб. четко выраженным спектр. линиям 589,0 и 589,9 нм. Количественно Н. определяют
пламенной фотометрией (вплоть до 0,0002 мг/л), спектр. или гравиметрич. методами.
В последнем случае Н. отделяют от др. щелочных элементов в виде хлорида, сульфата
или перхлората, чаще-в виде NaM(UO2)3 (СН3СОО)9.6Н2O,
где М - Mg, Zn, Mn, Ni, с послед. оксидиметрич. титрованием, а также используют
люминесцентное, колориметрич., нефелометрич. (при малых содержаниях Н.) определения.
Используют хроматографич., радиометрич. и спектрофотометрич. методы определения
Н.
Применение. Н. и
его сплавы с К-жидкие теплоносители, в частности в ядерных реакторах. Пары Н.
используют для наполнения газоразрядных ламп; сплавы Pb-Na-в произ-ве Рb(С2Н5)4,
для изготовления подшипников. Н. применяют как модификатор алюминиевых и др.
сплавов, восстановитель в металлургии (в произ-ве Ti, Zr, Та), орг. синтезе
(как сам Н., так и его амальгама), для получения соед. Na, как катализатор в
синтезе бутадиенового каучука. Амальгаму Na используют при получении NaOH высокой
чистоты; изотоп 24Na-для радиологич. лечения нек-рых форм лейкемии
и в диагностич. целях. Изотоп 22Na-позитронный источник.
Мировое произ-во (без социалистич.
стран) превышает 300 тыс. т/год (1980).
Хранят Н. под слоем инертной
обезвоженной жидкости (керосин, минер. масло и др.), перевозят только в запаянных
металлич. сосудах.
Металлич. Н. получил впервые
в 1807 Г. Дэви.
Лит.: Ситтиг М.,
Натрий, его производство, свойства и применение, пер. с англ., М., 1961; Foust
O.J., Sodium-NaK engineering handbook, v. 1-5, N.-Y.-[a.oJ,1972-1979. См. также
лит. при ст. Литий.
Л.Ю. Аликберова.

