Графит
ГРАФИТ (нем. Graphit, от греч. grapho-пишу), аллотропная модификация углерода, наиб. устойчивая при обычных условиях. Г.-распространенный в природе минерал. Встречается обычно в виде отдельных чешуек, пластинок и скоплений, разных по величине и содержанию Г. Различают месторождения кристаллич. Г., связанного с магматич. горными породами или кристаллич. сланцами, и скрытокристаллич. Г., образовавшегося при метаморфизме углей. В кристаллич. сланцах содержание Г. составляет 3-20%, в магматич. горных породах 3-50%, в углях 60-85%.
Кристаллическая структура. Кристаллич. решетка Г. (рис. 1) гексагональная
(а = 0,24612 нм, с = 0,67079 нм, z = 4, пространств. группа C6/mmc,
теоретич. плотн. 2,267 г/см3). Состоит из параллельных слоев
(базисных плоскостей), образованных правильными шестиугольниками из атомов
С. Углеродные атомы каждого слоя расположены против центров шестиугольников,
находящихся в соседних слоях (нижнем и верхнем); положение слоев повторяется
через один, а каждый слой сдвинут относительно другого в горизонтальном
направлении на 0,1418 нм.
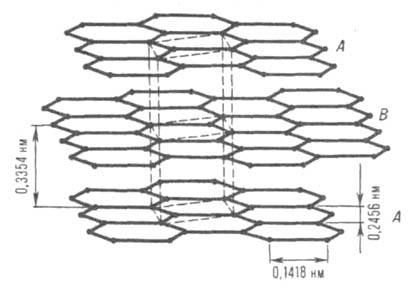
Рис. 1. Кристаллич. решетка графита (природного цейлонского). А, В углеродные слои; пунктирными линиями показана элементарная кристаллич. ячейка.
Известна также модификация с ромбоэдрич. решеткой (а = 0,3635
нм,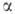 =
39,49°, z = 4, пространств. группа R3m). Положение плоских слоев
в ее структуре повторяется не через один слой, как в гексагон. модификации,
а через два. В прир. Г. содержание ромбоэдрич. структуры доходит до 30%,
в искусственно полученных Г. наблюдается только гексагональная. При 2230-3030oС
ромбоэдрич. Г. полностью переходит в гексагональный.
=
39,49°, z = 4, пространств. группа R3m). Положение плоских слоев
в ее структуре повторяется не через один слой, как в гексагон. модификации,
а через два. В прир. Г. содержание ромбоэдрич. структуры доходит до 30%,
в искусственно полученных Г. наблюдается только гексагональная. При 2230-3030oС
ромбоэдрич. Г. полностью переходит в гексагональный.
Внутри слоя связи между атомами ковалентные, образованы 5р2-гибридными орбиталями. Взаимод. между слоями осуществляются ван-дер-ваальсовыми силами. Для природного (цейлонского) Г. межслоевое расстояние при нормальных условиях 0,3354 нм. Энергия связи между слоями гексагон. Г. составляет 16,75 Дж/моль (15 °С), 15,1 Дж/моль (-134,15°С). Энергия связи С—С в слое 167,6 Дж/моль (1118°С).
В кристаллич. решетке Г. могут наблюдаться вздутия, искривления углеродных сеток и дефекты тонкого строения. В результате коагуляции вакансий могут образоваться микрополости диам. до 3 мкм. Объединение отдельных участков этих дефектов приводит к возникновению краевых дислокаций, а также дислокац. петель величиной 0,1-1,0 мкм. Концентрация вакансий в Г. увеличивается при его нагревании, напр. при 3650°С она достигает 0,5 атомных %. Дефекты могут возникать и при внедрении в решетку как углеродных атомов, так и гетероатомов (см. Графита соединения).
Свойства. Г.-жирное на ощупь в-во черного или серо-черного цвета с металлич. блеском. Его св-ва зависят от происхождения или способа получения. наиб. правильные кристаллы образует минерал цейлонских месторождений. Искусственно Г. получают: нагреванием смеси кокса или каменного угля с пеком (т. наз. ачесоновский Г.); термомех. обработкой смеси, содержащей кокс, пек, прир. Г. и карбидообразующие элементы (рекристаллизованный Г.); пиролизом газообразных углеводородов (пирографит). К разновидностям искусственно полученного Г. относят также доменный Г. (выделяется при медленном охлаждении больших масс чугуна) и карбидный Г. (образуется при термич. разложении карбидов).
При атм. давлении выше 2000 °С Г. возгоняется, в парах обнаружены молекулы,
содержащие от одного до семи атомов С. При высоких давлениях и нагревании
образуется алмаз (рис. 2). Тройная точка (Г.-жидкость-пар): т-ра 4130 К,
давл. 12 МПа. наиб. плотность (в зависимости от добавки 2,0-5,0 г/см3)
имеет рекристаллизованный Г. Ниже приводятся термодинамич. св-ва ачесоновского
Г.: С°p 8,54 Дж/(моль*К), ур-ние температурной зависимости:
Сop = а + bТ- сТ2 - dT2
- еТ3 (288^130 К), где а = 4,824, Ъ = 28,627*10-3,
с = 3,250*105, d = 13,812*10-6, e =
2,276* 10-9;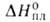 104кДж/моль, Soпл 24 Дж/(моль*К);
104кДж/моль, Soпл 24 Дж/(моль*К);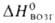 716,67 кДж/моль (288 К); S^98 5,74 Дж/(моль*К). Для Г. разл.
происхождения
716,67 кДж/моль (288 К); S^98 5,74 Дж/(моль*К). Для Г. разл.
происхождения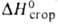 ок. -395 кДж/моль.
ок. -395 кДж/моль.
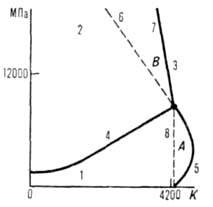
Рис. 2. Диаграмма состояния углерода: 1 и 2-области устойчивости соотв. графита и алмаза; 3 -область существования расплава углерода; 4 -линия равновесия графит-алмаз; 5, 6, 7, 8-линии плавления соотв. графита, метастабильного графита (приблизит. граница существования метастабильного графита в поле алмаза), алмаза и метастабильного алмаза в поле графита (приблизит. граница); А и В-области существования термодинамически неустойчивых алмаза и графита соответственно.
Высокая анизотропия св-в монокристаллов Г. обусловлена строением его кристаллич. решетки. В направлении базисных плоскостей тепловое расширение Г. до 427 °С отрицательно (т.е. Г. сжимается), его абс. значение с повышением т-ры уменьшается. Выше 427 °С тепловое расширение становится положительным. Температурный коэф. линейного расширения равен -1,2*10-6 К-1 (до -73oС), 0 (427 °С), 0,7*10-6 К-1 (выше 727°С). В направлении, перпендикулярном базисным плоскостям, тепловое расширение положительно, температурный коэф. линейного расширения практически не зависит от т-ры и превышает более чем в 20 раз среднее абс. значение этого коэф. для базисных плоскостей. Температурный коэф. линейного расширения поликристал-лич. Г. очень быстро увеличивается в интервале —100-0 °С, затем рост его замедляется; для наиб. распространенных Г. эти коэф. одинаковы и равны 0,2*10-8 К-1 в интервале 0-500°С и 0,4*10-9 К"1 выше 1000°С.
Для монокристаллов Г. отношение значений теплопроводности в направлениях, параллельном и перпендикулярном базисным плоскостям (коэф. анизотропии k), может достигать 5 и более. Теплопроводность [Вт/(м*К)] в направлении базисных плоскостей для Г.: цейлонского 278,4 (k = 3,2), камберлендского 359,6 (k = 6), канадского 522,0 (k = 6), пирографита 475-2435 (k = 100-800). Наивысшей теплопроводностью (большей, чем у Си) обладает рекристаллизованный Г. с добавками карбидов Ti и Zr. Теплопроводность искусственно полученного поликристаллич. Г. сильно зависит от его плотности и составляет 92,22, 169,94 и 277,44 Вт/(м*К) при плотности соотв. 1,41, 1,65 и 1,73 г/см3. На кривой температурной зависимости теплопроводности имеется максимум, положение и величина к-рого зависят от размеров и степени совершенства кристаллов.
Электрич. проводимость монокристаллов Г. в направлении, параллельном
базисной плоскости (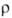 0,385*10-6
Ом*м), близка к металлической, в перпендикулярном-в сотни раз меньше, чем
у металлов (52,0*10-6 Ом*м). Величина
0,385*10-6
Ом*м), близка к металлической, в перпендикулярном-в сотни раз меньше, чем
у металлов (52,0*10-6 Ом*м). Величина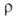 принимает миним. значение в интервале 0-1000 °С, положение минимума смещается
в область низких т-р тем больше, чем совершеннее кристаллич. структура.
Наивысшую электрич. проводимость имеет рекристаллизованный Г.
принимает миним. значение в интервале 0-1000 °С, положение минимума смещается
в область низких т-р тем больше, чем совершеннее кристаллич. структура.
Наивысшую электрич. проводимость имеет рекристаллизованный Г.
Монокристаллы Г. диамагнитны, магн. восприимчивость велика в направлении, перпендикулярном базисным плоскостям ( -22*10-3), и незначительна в параллельном направлении ( -0,5*10-3). Знак коэф. Холла меняется с положительного на отрицательный при 2100°С.
Прочностные св-ва Г. изменяются с увеличением т-ры. Для большинства
искусств. Г.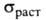 с повышением т-ры возрастает в 1,5-2,5 раза, достигая максимума при 2400-2800°С;
с повышением т-ры возрастает в 1,5-2,5 раза, достигая максимума при 2400-2800°С;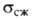 увеличивается
в 1,3-1,6 раза в интервале 2200-2300 °С; модули упругости и сдвига возрастают
в 1,3-1,6 раза в интервале 1600-2200 °С. С повышением т-ры до 3000 °С и
выше прочностные св-ва довольно резко снижаются и при 3200 °С приближаются
к св-вам при 20 °С В интервале 20-2000 °С Г. хрупок. В диапазоне 2200-2600
°С наблюдается большая остаточная деформация, достигающая 0,35-1,5% в зависимости
от вида Г. Для искусственно полученного поликристаллич. Г.
увеличивается
в 1,3-1,6 раза в интервале 2200-2300 °С; модули упругости и сдвига возрастают
в 1,3-1,6 раза в интервале 1600-2200 °С. С повышением т-ры до 3000 °С и
выше прочностные св-ва довольно резко снижаются и при 3200 °С приближаются
к св-вам при 20 °С В интервале 20-2000 °С Г. хрупок. В диапазоне 2200-2600
°С наблюдается большая остаточная деформация, достигающая 0,35-1,5% в зависимости
от вида Г. Для искусственно полученного поликристаллич. Г.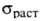 9,8-14,7 МПа,
9,8-14,7 МПа,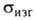 19,6-21,6 МПа,
19,6-21,6 МПа,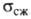 24,5-29,4 МПа; коэф. Пуассона 0,20-0,27; твердость по Бринеллю 392-588
МПа, по шкале Мооса 1-2. наиб. высокие прочностные св-ва имеет рекристаллизованный
Г.
24,5-29,4 МПа; коэф. Пуассона 0,20-0,27; твердость по Бринеллю 392-588
МПа, по шкале Мооса 1-2. наиб. высокие прочностные св-ва имеет рекристаллизованный
Г.
Хорошие антифрикционные св-ва Г. обусловлены легкостью скольжения одного углеродного слоя относительно другого под действием малых сдвиговых напряжений в направлении базисных плоскостей. Коэф. трения по металлам (для рабочих скоростей до 10 м/с) составляют 0,03-0,05. Для пирографита под действием напряжений в направлении, перпендикулярном базисным плоскостям, он составляет 0,4-0,5; пирографит м. б. использован в кач-ве фрикционного материала.
После облучения Г. нейтронами его физ. св-ва изменяются: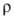 увеличивается, а прочность, модуль упругости, твердость, теплопроводность
уменьшаются на порядок. После отжига при 1000-2000 °С св-ва восстанавливаются
до прежних значений. Г. обладает низким сечением захвата тепловых нейтронов
(0,38*10-30 м2).
увеличивается, а прочность, модуль упругости, твердость, теплопроводность
уменьшаются на порядок. После отжига при 1000-2000 °С св-ва восстанавливаются
до прежних значений. Г. обладает низким сечением захвата тепловых нейтронов
(0,38*10-30 м2).
Характерная особенность искусственно полученного Г.-его пористость,
оказывающая существенное влияние практически на все св-ва Г. Объем пор
от 2-3% для пирографита до 80-85% для др. видов Г. Для описания зависимости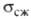 ,
модуля упругости, теплопроводности, р от пористости применяют эмпирич.
выражение:
,
модуля упругости, теплопроводности, р от пористости применяют эмпирич.
выражение: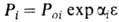 где Рi и Рoi—св-ва соотв. пористого и непористого
Г.,
где Рi и Рoi—св-ва соотв. пористого и непористого
Г.,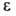 -общая пористость,
-общая пористость,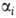 -параметр
для i-того св-ва.
-параметр
для i-того св-ва.
Г. весьма инертен при нормальных условиях. Окисляется О2
воздуха до СО2 выше 400°С, СО2-выше 500 °С. Т-ра
начала р-ций тем выше, чем совершеннее кристаллич. структура Г. Окисление
ускоряется в присут. Fe, V, Na, Cu и др. металлов, замедляется в присут.
С12, соед. фосфора и бора. С молекулярным азотом Г. практически
не реагирует, с атомарным при обычной т-ре образует цианоген C2N2,
в присут. Н2 при 800°C-HCN. В условиях тлеющего разряда Г. с
N2 дает парацианоген (CN)X, где х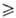 2.
С оксидами азота выше 400 °С образует СО2, СО и N2,
с Н2 при 300-1000 °С-СН4. Галогены внедряются в кристаллич.
решетку Г., давая соед. включения (см. Графита соединения).
2.
С оксидами азота выше 400 °С образует СО2, СО и N2,
с Н2 при 300-1000 °С-СН4. Галогены внедряются в кристаллич.
решетку Г., давая соед. включения (см. Графита соединения).
С большинством металлов и их оксидов, а также со мн. неметаллами Г. дает карбиды. Со всеми щелочными металлами, нек-рыми галогенидами, оксифторидами, галогеноксидами, оксидами и сульфидами металлов образует соед. включения, с нитридами металлов выше 1000 °С- твердые р-ры нитридов и карбидов, с боридами и карбидами-эвтектич. смеси с т-рами плавления 1800-3200°С. Г. стоек к действию к-т, р-ров солей, расплавов фторидов, сульфидов, теллуридов, орг. соед., жидких углеводородов и др., реагирует с р-рами щелочей, жидкими окислителями и рядом хлор- и фторорг. соединений.
Наиб, химически и термически стоек пирографит. Он практически непроницаем для газов и жидкостей, при 600 °С его стойкость к окислению во мн. раз выше, чем у других Г. В инертной среде пирографит работоспособен при 2000 °С в течение длительного времени.
Получение. Кристаллич. Г. извлекают из руд методом флотации, руды скрытокристаллич. Г. используют без обогащения.
Исходное сырье для получения Г.-нефтяной или метал-лургич. кокс, антрацит и пек. Отдельные частицы исходных углеродных материалов в результате карбонизации при обжиге связываются в монолитное твердое тело, к-рое затем подвергают графитации (кристаллизации). По одному из методов кокс или антрацит измельчают и смешивают с пеком в определенных соотношениях, прессуют при давл. до 250 МПа, а затем подвергают обжигу при 1200°С и графитации при нагр. до 2600-3000 °С. Для уменьшения пористости полученный Г. пропитывают синтетич. смолой или жидким пеком, после чего снова подвергают обжигу и графитации. В произ-ве Г. повыш. плотности пропитку, обжиг и графитацию повторяют до пяти раз.
Из смеси, содержащей кокс, пек, прир. Г. и до 20% тугоплавких карбидообразующих элементов (напр., Ti, Zr, Si, Nb, W, Та, Мо, В), получают рекристаллизованный Г. Исходную шихту нагревают в графитовых прессформах до т-ры, на 100-150 °С превышающей т-ру плавления эвтектич. смеси карбида с углеродом, под давл. 40-50 МПа в течение неск. десятков минут.
Пирографит получают пиролизом газообразных углеводородов с осаждением образовавшегося углерода из газовой фазы на подложку из Г. Осадки имеют кристаллич. структуру разл. степени совершенства - от турбостратной неупорядоченной (пироуглерод) до упорядоченной графитовой (пирографит).
Применение. Г. используют в металлургии для изготовления плавильных тиглей и лодочек, труб, испарителей, кристаллизаторов, футеровочных плит, чехлов для термопар, в кач-ве противопригарной "присыпки" и смазки литейных форм. Он также служит для изготовления электродов и нагревательных элементов электрич. печей, скользящих контактов для электрич. машин, анодов и сеток в ртутных выпрямителях, самосмазывающихся подшипников и колец электромашин (в виде смеси с Al, Mg и Pb под назв. "графаллой"), вкладышей для подшипников скольжения, втулок для поршневых штоков, уплотнительных колец для насосов и компрессоров, как смазка для нагретых частей машин и установок. Его используют в атомной технике в виде блоков, втулок, колец в реакторах, как замедлитель тепловых нейтронов и конструкц. материал (для этих целей применяют чистый Г. с содержанием примесей не более 10-2% по массе), в ракетной технике - для изготовления сопел ракетных двигателей, деталей внеш. и внутр. теплозащиты и др., в хим. машиностроении - для изготовления теплообменников, трубопроводов, запорной арматуры, деталей центробежных насосов и др. для работы с активными средами. Г. используют также как наполнитель пластмасс (см. Графитопласты), компонент составов для изготовления стержней для карандашей, при получении алмазов. Пирографит наносится в виде покрытия на частицы ядерного топлива. См. также Угле графитовые материалы.
Наиб. кол-во прир. Г. добывают в СССР, ЧССР, Южной Корее, Мексике, Австрии, ФРГ, лучшие сорта крупнокристаллич. Г.-на Цейлоне и Мадагаскаре. Произ-во Г. сосредоточено в промышленно развитых странах (Великобритания, СССР, США, Франция, ФРГ, Япония) и достигает сотен тыс. тонн в год.
Лит.: Веселовский В. С, Угольные и графитовые конструкционные материалы, М., 1966; Шулепов С. В., Физика углеграфитовых материалов, М., 1972; Рекристаллизованный графит, М., 1979; Костиков В. И., Варенков А. Н., Взаимодействие металлических расплавов с углеродными материалами, М., 1981.
В. И. Костиков.

