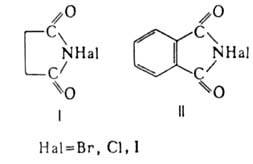
N-галогенимиды
СВОЙСТВА N-ГАЛОГЕНИМИДОВ
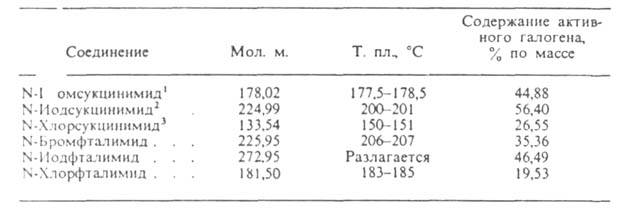
1
d420
2,12;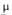 7,014*10-30 Кл*м (диоксан; 20°С). 2 d420
2,245;
7,014*10-30 Кл*м (диоксан; 20°С). 2 d420
2,245;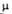 3,24*10-30 Кл*м (диоксаи; 20oС). 3 d420
1,66;
3,24*10-30 Кл*м (диоксаи; 20oС). 3 d420
1,66; 9,55*10-30 Кл*м (диоксан; 20°С).
9,55*10-30 Кл*м (диоксан; 20°С).
По св-вам близки N-галогенамидам карбоновых и сульфоновых к-т. Содержат высокореакционноспособный атом галогена, к-рый в присут. воды легко отщепляется с образованием к-ты HOHal, благодаря чему Г.-мягкие окисляющие и галогенирующие агенты.
Они
окисляют, напр., гидразин и NH3 до N2; первичные
и вторичные спирты в водном диоксане или воде соотв. до альдегидов и кетонов; гидроксикетоны
до
гидроксикетоны
до дикетонов.
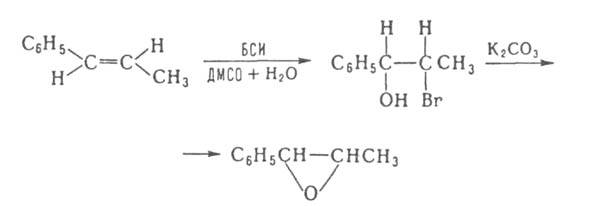
N-Бромсукцинимид (БСИ) используют для получения эпоксидов из олефинов;
напр., транс-1-фенил-1-пропен превращ. в эритро-2-бром-1-фенилпропанол
(выход 92%) и далее - в эпоксид по схеме:
дикетонов.
N-Бромсукцинимид (БСИ) используют для получения эпоксидов из олефинов;
напр., транс-1-фенил-1-пропен превращ. в эритро-2-бром-1-фенилпропанол
(выход 92%) и далее - в эпоксид по схеме:
Аллильные
метиленовые группы окисляются БСИ на свету в водном ТГФ до карбонильных
групп. БСИ и N-хлорсукцинимид (ХСИ) в безводном метаноле окисляют алкилсульфиды
до сульфоксидов (выход 85-93%), диарнлсульфиды - до сульфоксидов и сульфонов;
декарбоксилируют карбоновые к-ты, аминокислоты,
пептиды, напр.:
аминокислоты,
пептиды, напр.:
CH3CH(NH2)COOH -> СН3СНО + NH3 + СО2
В безводной
апротонной среде, напр. СС14, Г., кроме иод-производных, галогенируют
(радикальный механизм) олефины в аллильное положение, не затрагивая двойной
связи (р-ция Воля - Циглера), алкиларены - в боковую цепь. В присут. протонных
или апротонных к-т Г. галогенируют разл. ароматич. и гетероароматич. соединения
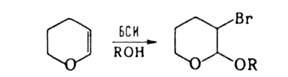
в ядро по ионному механизму. В протонном р-рителе (спиртах или уксусной
к-те) р-ция с олефинами проходит с образованием бромэфиров, напр.:
бромэфиров, напр.:
Иодирование N-иодсукцинимидом (ИСИ) происходит по ионному механизму. ХСИ хлорирует 2-пиридон до 5-хлор-2-пиридона (выход 95%), анилин и N-алкиланилины-до о- и n-хлорпроизводных.
N-Бром-
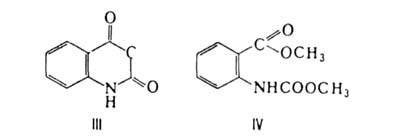
и N-хлорфталимиды (соотв. БФИ и ХФИ) при взаимод. с 40%-ным р-ром NaOH
(0-3 °С) образуют изатовый ангидрид (выход 90-92%), с CH3ONa-
диметиловый эфир изатовой к-ты (N-карбоксиантраниловой к-ты) - ф-лы III
и IV соответственно:
В пром-сти получают: БСИ -бромированием сукцинимида Вr2 в разб. H2SO4 при 25-30°С в присут. NaBr (выход 90%); ХСИ-действием на р-р сукцинимида в уксусной к-те хлорной известью или КСЮ (выход 85%); БФИ и ХФИ-галогенированием водного р-ра фталимида и NaOH при 0-8°С (выход 90-95%). В лаборатории синтезируют ИСИ и N-иодфталимид действием 12 соотв. на р-р сукцинимида в диоксане при 50°С (выход 80-85%) и на водный р-р фталимида с NaOH в присутствии Вг2 или С12.
БСИ применяют в произ-ве кортизона и витамина D3; БФИ - в фото резисторах, галогенсеребряных фотоэмульсиях; ХФИ-вулканизующий агент, промежут. продукт в произ-ве гербицидов.
Лит.:
Реакции
и методы исследования органических соединений, кн. 6, М., 1957, с. 37-63;
Физер Л., Физер М., Реагенты для органического синтеза, пер. с англ., т.
I, 2, 4, 5, 6, М.. 1970-75. Н. Б. Карпова.

