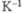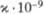Фосфор
ФОСФОР (от греч.
phosphoros - светоносный; лат. Phosphorus) P, хим. элемент V гр. периодич. системы;
ат. номер 15, ат. м. 30,97376. Имеет один устойчивый нуклид 31P.
Эффективное сечение захвата тепловых нейтронов 18 · 10-30 м2.
Конфигурация внеш. электронной оболочки атома 3s23p3;
степени окисления -3, +3 и +5; энергия последоват. ионизации при переходе
от Р° до P5+ (эВ): 10,486, 19,76, 30,163, 51,36, 65,02; сродство
к электрону 0,6 эВ; электроотрицательность по По-лингу 2,10; атомный радиус
0,134 нм, ионные радиусы (в скобках указаны координац. числа) 0,186 нм для P3-
, 0,044 нм (6) для P3+, 0,017 нм (4), 0,029 нм (5), 0,038 нм (6)
для P5+.
Среднее содержание Ф. в
земной коре 0,105% по массе, в воде морей и океанов 0,07 мг/л. Известно ок.
200 фосфорных минералов,
все они представляют собой фосфаты. Из них важнейший - апатит, к-рый
является основой фосфоритов. Практич. значение имеют также монацит CePO4,
ксенотим YPO4, амблигонит LiAlPO4(F, ОН), трифилин Li(Fe,
Mn)PO4, торбернит Cu(UO2)2(PO4)2·
12H2O, отунит Ca(UO2)2(PO4)2
x x 10H2O, вивианит Fe3(PO4)2· 8H2O,
пироморфит Рb5(РО4)3С1, бирюза СuА16(РО4)4(ОН)8·
5Н2О.
Свойства. Известно
св. 10 модификаций Ф., из них важнейшие - белый, красный и черный Ф. (техн.
белый Ф. наз. желтым Ф.). Единой системы обозначений модификаций Ф. нет. Некоторые
св-ва важнейших модификаций сопоставлены в табл. Термодинамически устойчив при
нормальных условиях кристаллич. черный Ф. (P I). Белый и красный Ф. мета-стабильны,
но вследствие малой скорости превращения могут практически неограниченное время
сохраняться при нормальных условиях.
СВОЙСТВА ВАЖНЕЙШИХ МОДИФИКАЦИЙ
ФОСФОРА
|
Показатель |
Белый Р Ш |
Красный P II |
Черный P I |
||
|
Сингония |
Кубич. |
Моноклинная |
Ромбич. |
||
|
Параметры элементарной
ячейки: |
|
|
|
||
|
а, нм |
1,851 |
1,02 |
0,33136 |
||
|
b, нм |
— |
0,936 |
0,4376 |
||
|
с, нм |
— |
2,51 |
1,0478 |
||
|
|
— |
118,8 |
— |
||
|
z |
224 |
84 |
8 |
||
|
Пространств. группа |
I43т |
Р2/с |
Стса |
||
|
Плотн., г/см3 |
1,828 |
2,31 |
2,702 |
||
|
T. пл., 0C |
44,14 |
593а |
1000а |
||
|
T. возг., 0C |
287б |
429 |
453 |
||
|
|
23,8 |
21,2 |
21,6 |
||
|
|
0,66 |
25,96 |
— |
||
|
|
13,1в |
128,6 |
53,75 |
||
|
|
0 |
-17,4 |
-39,35 |
||
|
|
41,1 |
22,85 |
22,7 |
||
|
Теплопроводность,
Вт/(м · К) |
0,56 |
— |
— |
||
|
Температурный коэф.
линейного расширения, К-1 |
3,76·10-6 |
— |
— |
||
|
|
15, 4 · 10-8 |
107-1012 |
0,015 |
||
|
Температурный коэф.
р, |
45, 6 · 10-3 |
— |
7,7 -10-3 |
||
|
Ширина запрещенной
зоны, эВ |
2,1 |
1,55 |
0,33 |
||
|
Магн. восприимчивость,
|
-0,86 |
-0,67 |
-0,27 |
||
а Под
давлением. б Т-ра кипения. 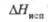
Белый Ф. (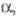 P III) образуется при конденсации паров и затвердевании расплава. Это белая
прозрачная воскообразная масса (при охлаждении становится хрупкой) или прозрачные
кристаллы, из-за высокой дисперсии света и большого показателя преломления похожие
на алмазы. При -76,9 0C он превращается в
P III) образуется при конденсации паров и затвердевании расплава. Это белая
прозрачная воскообразная масса (при охлаждении становится хрупкой) или прозрачные
кристаллы, из-за высокой дисперсии света и большого показателя преломления похожие
на алмазы. При -76,9 0C он превращается в 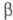 -модификацию
белого Ф. (P IV) с плотн. 1,88 г/см3 с гексагон. [по др. данным,
с ромбич. или кубич. (а = 0,734 нм)] кристаллич. решеткой;
-модификацию
белого Ф. (P IV) с плотн. 1,88 г/см3 с гексагон. [по др. данным,
с ромбич. или кубич. (а = 0,734 нм)] кристаллич. решеткой;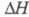 перехода
перехода 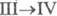 0,522 кДж/моль. В структуре белого Ф. содержатся тетраэд-рич. молекулы P4.
В
0,522 кДж/моль. В структуре белого Ф. содержатся тетраэд-рич. молекулы P4.
В 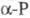 они
могут свободно вращаться, в
они
могут свободно вращаться, в 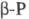 этого нет. Такие же молекулы наблюдаются в расплаве и парах Ф. Только выше ~
800 0C начинается диссоциация на молекулы P2. При конденсации
таких паров при -190 0C образуется неустойчивая модификация - коричневый
Ф., состоящий, по-видимому, из молекул P2. Выше -100 0C
он превращается в смесь белого и красного (P II) Ф.
этого нет. Такие же молекулы наблюдаются в расплаве и парах Ф. Только выше ~
800 0C начинается диссоциация на молекулы P2. При конденсации
таких паров при -190 0C образуется неустойчивая модификация - коричневый
Ф., состоящий, по-видимому, из молекул P2. Выше -100 0C
он превращается в смесь белого и красного (P II) Ф.
Зависимость давления пара
белого Ф. от т-ры: для твердого lg p (мм рт. ст.) = 19,0925 - 35291,4/Т-
3,5 lg T (273-317 К); для жидкого lg p (мм рт. ст.) = 4,512-2660/Т+1,243
lg T (317,3-530 К). Расплав белого Ф. очень легко переохлаждается. Плотн.
расплава 1,749 г/см3.
Нагревание (без доступа
воздуха) выше ~ 180 0C разрушает систему связей групп P4,
в результате чего начинается полимеризация, приводящая к превращению в красный
Ф. Описан целый ряд разновидностей красного Ф., различающихся по цвету - от
оранжевого и ярко-красного до коричневого и черно-фиолетового, по плотности
(2,0-2,4 г/см3), т-ре плавления (585-610 0C) и т.п. При
250-300 0C образуется аморфный
красный Ф. 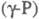 с плотн. 2,16 г/см3; при 360-450 0C -моноклинный красный
Ф. (P П,
с плотн. 2,16 г/см3; при 360-450 0C -моноклинный красный
Ф. (P П, 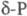 );
при ~ 500 0C - другая моноклинная модификация, также образующаяся
при натр, белого Ф. с Pb или Bi (т. наз. Ф. Гитторфа, фиолетовый Ф.) с параметрами
решетки а = 0,924 нм, в = 0,921 нм, с = 2,23 нм,
);
при ~ 500 0C - другая моноклинная модификация, также образующаяся
при натр, белого Ф. с Pb или Bi (т. наз. Ф. Гитторфа, фиолетовый Ф.) с параметрами
решетки а = 0,924 нм, в = 0,921 нм, с = 2,23 нм, 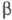 =107,4°. При длит. нагревании при ~ 600 0C образуется кубич.
красный Ф. (пространств, группа РтЗт, а= 1,131 нм, z = 66, плотн.
2,35 г/см3). Описаны также трик-линный, тетрагон., гексагон. красный
Ф. и др. Превращение Ф. белый
=107,4°. При длит. нагревании при ~ 600 0C образуется кубич.
красный Ф. (пространств, группа РтЗт, а= 1,131 нм, z = 66, плотн.
2,35 г/см3). Описаны также трик-линный, тетрагон., гексагон. красный
Ф. и др. Превращение Ф. белый  Ф. красный ускоряется при действии УФ облучения, а также в присут. примесей
I2, S, Se и т.д. В структуре красного Ф. существуют связанные между
собой бесконечные цепи из тетраэдров P4. В этой структуре м. б. выделены
группировки P8 и P9. При испарении и плавлении красного
Ф. (при атм. давлении он сублимируется и м. б. расплавлен при давлении 4,5 МПа)
образуются молекулы P4. Ур-ние зависимости давления пара твердого
красного Ф. от т-ры: lgp (мм рт. ст.) = 14,207 - 6300/Т+ 3,298Т+
0,156 lg Т (298- 866 К).
Ф. красный ускоряется при действии УФ облучения, а также в присут. примесей
I2, S, Se и т.д. В структуре красного Ф. существуют связанные между
собой бесконечные цепи из тетраэдров P4. В этой структуре м. б. выделены
группировки P8 и P9. При испарении и плавлении красного
Ф. (при атм. давлении он сублимируется и м. б. расплавлен при давлении 4,5 МПа)
образуются молекулы P4. Ур-ние зависимости давления пара твердого
красного Ф. от т-ры: lgp (мм рт. ст.) = 14,207 - 6300/Т+ 3,298Т+
0,156 lg Т (298- 866 К).
При давлении более 1,2
ГПa белый Ф. переходит в кристаллич. черный Ф. (P I, 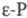 ).
Для перехода красного Ф. требуется более высокое давление (2,5 ГПа), нагревание
до ~ 200 0C облегчает переход. При меньших давлениях образуется аморфный
черный F. (i-P) с плотн. 2,25 г/см3. Кристаллич.
черный Ф. может быть получен и при атм. давлении -длит. нагреванием красного
Ф. с ртутью при ~ 300 0C в присут. затравки. Черный Ф. графитоподобный,
его структура состоит из слабо связанных между собой гофрированных слоев. При
атм. давлении черный Ф. возгоняется без плавления, ур-ние зависимости давления
пара от т-ры lg r (мм рт. ст.) = 13,36-7560/Т. Плавится он
при ~ 1000 0C под давлением 1,8 ГПа, экстраполяция на атм. давление
дает т. пл. 606 0C. При натр, черный Ф. при давлении собств. паров
при 560-580 С превращается в красный.
).
Для перехода красного Ф. требуется более высокое давление (2,5 ГПа), нагревание
до ~ 200 0C облегчает переход. При меньших давлениях образуется аморфный
черный F. (i-P) с плотн. 2,25 г/см3. Кристаллич.
черный Ф. может быть получен и при атм. давлении -длит. нагреванием красного
Ф. с ртутью при ~ 300 0C в присут. затравки. Черный Ф. графитоподобный,
его структура состоит из слабо связанных между собой гофрированных слоев. При
атм. давлении черный Ф. возгоняется без плавления, ур-ние зависимости давления
пара от т-ры lg r (мм рт. ст.) = 13,36-7560/Т. Плавится он
при ~ 1000 0C под давлением 1,8 ГПа, экстраполяция на атм. давление
дает т. пл. 606 0C. При натр, черный Ф. при давлении собств. паров
при 560-580 С превращается в красный.
При давлении 8,6 ГПа образуется
Ф. V с ромбоэдрич. структурой типа 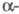 As
с плотн. 3,56 г/см3 (пространств, группа R3m, z = 2, а
= 0,3524 нм,
As
с плотн. 3,56 г/см3 (пространств, группа R3m, z = 2, а
= 0,3524 нм, 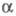 =57,25°).
При 10 ГПа он переходит в модификацию VI с кубич. структурой типа NaCl (а
= 0,2377 нм, z = 1) с плотн. 3,83 г/см3. Есть указания на
существование при высоких давлениях и др. модификаций Ф.
=57,25°).
При 10 ГПа он переходит в модификацию VI с кубич. структурой типа NaCl (а
= 0,2377 нм, z = 1) с плотн. 3,83 г/см3. Есть указания на
существование при высоких давлениях и др. модификаций Ф.
Белый и красный Ф.- диэлектрики,
черный Ф.- полупроводник, модификации высокого давления, по-видимому, обладают
металлич. св-вами. Сверхпроводимость наблюдается у модификаций P V и P VI ниже
соотв. 4,7-6 К и 7,5-10 К (в зависимости от давления).
Белый Ф. очень активен.
При переходе к красному и особенно черному Ф. хим. активность резко снижается.
Белый Ф. на воздухе светится в темноте, с чем исторически связано его назв.
(греч. phosphoros - светоносный). Свечение обусловлено окислением (с образованием
низших оксидов) паров Ф- белый Ф. обладает заметной летучестью даже при низких
т-рах. Мелкодисперсный белый Ф. самовоспламеняется на воздухе, для компактного
т. воспл. 34-50 0C. В воде он почти не раств. (3 · 10-4%
при 15 0C), очень хорошо раств. в CS2 (89,8% при 10 0C),
раств. в PCl3, POCl3, жидких SO2, NH3,
мало раств. в этаноле (0,31%), диэтиловом эфире (1,04%), бензоле (3,2%), CCl4
(1,27%), глицерине (0,17%), уксусной к-те (~ 1%), ксилоле. Для красного и черного
Ф. р-рители не найдены.
Красный Ф. при комнатной
т-ре окисляется медленно, но нек-рые его образцы могут самовоспламеняться из-за
присут. следов белого Ф., а также наличия высокоактивного аморфного Ф. по границам
зерен. T. воспл. красного Ф. 210 С (черного Ф. ок. 500 0C), но большие
кол-ва красного Ф. при длит. хранении на воздухе могут загораться из-за повышения
т-ры вследствие окисления.
При горении Ф. образуется
оксид P4O10 (или P2O5, см. Фосфора
оксиды). С парами воды Ф. реагирует под давлением при 600-900 0C
в присут. катализаторов (Pt, Cu и др.) с вытеснением H2 и образованием
H3PO4 (см. Фосфорная кислота). Р-ры неокисляющих
минеральных к-т на Ф. не действуют, HNO3 окисляет его до H3PO4.
При нагр. Ф. с р-рами щелочей выделяется фосфин PH3. Белый
Ф. реагирует с р-рами
солей электроположит. металлов (Cu, Pb, Ag и др.), вытесняя их из р-ров с образованием
фосфидов. Красный и черный Ф. этой способностью не обладают.
С водородом Ф. в обычных
условиях не реагирует. Его гидриды (фосфины) получают косвенным путем. С фтором
и белый и красный Ф. реагируют со взрывом. Белый Ф. воспламеняется в атмосфере
хлора и паров брома, красный реагирует спокойно. Р-ция с иодом у белого Ф. идет
даже при охлаждении, тогда как у красного - при нагревании. Во всех случаях
образуются разл. фосфора галогениды. При натр. Ф. в атмосфере галогеноводородов
образуются фосфин и соли фосфония.
Пары Ф. реагируют с азотом
в электрич. разряде или на накаленной вольфрамовой нити с образованием смеси
аморфных нитридов P3N5 и PN. Обычно нитрид P3N5
(оранжево-коричневого цвета с плотн. 2,6 г/см3) получают взаимод.
P4S10 с NH3 при нагревании. При его термич.
разложении при ~ 800 0C м. б. получен полимерный низший нитрид PNx
переменного состава (х = 0,7 до 1,19). Нитриды Ф. инертны, холодная вода
на них не действует, они не разлагаются при нагр. в р-рах HCl, разб. HNO3,
р-рах щелочей, не реагируют с хлором, на воздухе начинают окисляться выше 250
0C. Нитрид P3N5 используют как газопоглотитель
в лампах накаливания и в галогенных лампах, для легирования кремния в технологии
полупроводниковых материалов.
Белый Ф. при сплавлении
с серой при т-рах до ~ 100 0C образует систему эвтектич. типа с ограниченными
твердыми р-рами, выше ~ 230 0C компоненты реагируют с образованием
серии сульфидов. Тетрафосфора трисульфид P4S3 - лимонно-желтые
кристаллы ромбич. сингонии (а = 1,063 нм, .b - 0,969 нм, с
= 1,372 нм, z = 8, пространств. группа РптЬ); т. пл. 172 0C,
т. кип. 407 0C; плотн. 2,03 г/см3; С0р
162,6 Дж/(моль·К); 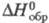 -130 кДж/моль;
-130 кДж/моль; 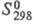 203,3 Дж/(моль·К); т. воспл. 80-89 0C; горячей водой медленно разлагается;
хорошо раств. в CS2 (50% при 17 0C), раств. в бензоле
(2,5%), толуоле (3%); получают взаимод. желгого или красного Ф. и серы выше
250 0C в атмосфере CO2; очищают перегонкой или перекристаллизацией
из CS2; компонент зажигат. смеси для спичечных коробок. Тетрафосфора
декасульфид P4S10 (или P2S5, пентасуль-фид)
- серовато-желтые кристаллы триклинной сингонии (а = 0,907 нм, b =
0,918 нм, с = 0,919 нм,
203,3 Дж/(моль·К); т. воспл. 80-89 0C; горячей водой медленно разлагается;
хорошо раств. в CS2 (50% при 17 0C), раств. в бензоле
(2,5%), толуоле (3%); получают взаимод. желгого или красного Ф. и серы выше
250 0C в атмосфере CO2; очищают перегонкой или перекристаллизацией
из CS2; компонент зажигат. смеси для спичечных коробок. Тетрафосфора
декасульфид P4S10 (или P2S5, пентасуль-фид)
- серовато-желтые кристаллы триклинной сингонии (а = 0,907 нм, b =
0,918 нм, с = 0,919 нм, 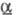 =92,4°,
=92,4°,
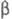 = 101,2°,
= 101,2°, 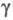 =110,5°,
z = 2, пространств, группа Pl); т. пл. 288 0C, т.кип. 514
0C; плотн. 2,09 г/см3; С°р 296 Дж/(моль·К);
=110,5°,
z = 2, пространств, группа Pl); т. пл. 288 0C, т.кип. 514
0C; плотн. 2,09 г/см3; С°р 296 Дж/(моль·К);
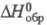 -364
кДж/моль; S0298 381,7 Дж/(моль·К); гигроскопичен,
разлагается горячей водой; мало раств. в CS2; реагирует со спиртами
и др. орг. р-рителями; получают аналогично P4S3; используют
в синтезе флотореагентов, антикоррозионных добавок к смазочным маслам, инсектицидов
и др. Известны также P4S5 и P4S7
и моносульфид PS (аморфный и кристаллический), а также селенид P4Se3
и теллурид Te3P2.
-364
кДж/моль; S0298 381,7 Дж/(моль·К); гигроскопичен,
разлагается горячей водой; мало раств. в CS2; реагирует со спиртами
и др. орг. р-рителями; получают аналогично P4S3; используют
в синтезе флотореагентов, антикоррозионных добавок к смазочным маслам, инсектицидов
и др. Известны также P4S5 и P4S7
и моносульфид PS (аморфный и кристаллический), а также селенид P4Se3
и теллурид Te3P2.
Пары Ф. реагируют с углеродом,
только выше 2000 0C. Косвенным путем, напр. р-цией PCl3
с Mg2C2I2, можно получить карбид P2C6
- светло-желтая аморфная масса, не взаимод. с водой, р-рами к-т и щелочей, но
загорается на воздухе при самом слабом нагревании. С CO2 Ф. реагирует
выше 650 0C с образованием СО и паров низших оксидов Ф. С СО не реагирует.
С кремнием пары Ф. взаимод.
выше 1000 0C с образованием желто-коричневого силицида SiP, устойчивого
до 1100 0C. Взаимод. гидридов PH3 и SiH4 получен
Si2P голубовато-черного цвета. Силициды Ф. устойчивы на воздухе,
гидролизу-ются горячей водой, разлагаются р-рами щелочей, а также минеральных
к-т при нагревании. С бором, а также со всеми металлами, кроме Sb и Bi, Ф. реагирует
при нагр. с образованием фосфидов.
Ф. большей частью образует
ковалентные связи как с одноименными атомами, так и с атомами др. элементов.
Редкое исключение - частично ионные связи в нек-рых фосфидах. Обычно наблюдаются
простые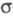 -связи.
Часто образуются полимеры с такими связями (элементарный Ф., оксиды, полифосфаты
и др.). Важнейшим соед. Ф. посвящены отдельные
статьи (см. Фосфора кислоты, Фосфаты неорганические, Фосфорорганические соединения
и др.).
-связи.
Часто образуются полимеры с такими связями (элементарный Ф., оксиды, полифосфаты
и др.). Важнейшим соед. Ф. посвящены отдельные
статьи (см. Фосфора кислоты, Фосфаты неорганические, Фосфорорганические соединения
и др.).
Получение. Ф. получают
восстановлением фосфоритов или апатита коксом в присут. SiO2 в электропечах
при 1300-1500 0C по р-ции:
4Ca5(PO4)3F
+ 21SiO2 + 30C 3P4 + 20CaSiO3 + SiF4 + З0СО
3P4 + 20CaSiO3 + SiF4 + З0СО
Образующиеся пары Ф. конденсируются
на охлаждаемой пов-сти в виде белого (желтого) Ф. и собираются под слоем нагретой
воды (60 0C). В случае присутствия в шихте оксидов железа в качестве
побочного продукта получается феррофос-фор - сплав фосфидов Fe2P
и Fe3P.
Красный Ф. получают нагреванием
белого без доступа воздуха в течение неск. часов при 375-400 0C.
Очищают белый Ф. отстаиванием
или фильтрованием расплава, переплавкой под слоем разб. хромовой смеси, обработкой
10-20%-ным р-ром KOH при 90-100 0C, 50%-ной H2SO4
и деионизированной водой при 41-50 0C, сублимацией или перегонкой
в вакууме либо перегонкой с водяным паром в атмосфере CO2, высокотемпературной
обработкой паров (900-1200 0C) на кварцевой насадке, зонной плавкой.
Кристаллы белого Ф. получают испарением р-рителя из его р-ров в CS2
или бензоле.
Красный Ф. очищают обработкой
3-5%-ными водными р-рами минеральных к-т при 70 0C, кипячением с
7%-ным р-ром щелочи, а затем кипячением с деионизированной водой. Ф. высокой
чистоты получают гидридным методом -термич. разложением очищенного ректификацией
фосфина.
Определение. Известные
р-ции обнаружения и определения Ф. в осн. относятся к ортофосфатным ионам. Для
качеств, обнаружения преим. применяют р-цию образования при действии молибдата
аммония в азотнокислой среде желтого осадка (или желтого окрашивания р-ра) фосфоромолибдата
аммония. Действие молибдата аммония в присут. бензидина или нек-рых др. восстановителей
дает синее окрашивание (используют в виде капельной р-ции на Ф.). Аналогичная
р-ция применяется для проявления пятен разл. фосфатов в бумажной хроматографии.
Наиб. употребительный гравиметрич.
способ определения Ф. (если он находится в низших степенях окисления, его предварительно
окисляют) - вышеуказанная р-ция осаждения фосфоромолибдата аммония с послед.
переосаждением в виде MgNH4РO4·6H2O и прокаливанием
осадка до Mg2P4O7 (весовая форма).
Титриметрич. фосфоромолибдатный
метод заключается в осаждении фосфоромолибдата аммония, растворении осадка в
титрованном р-ре щелочи и титровании его избытка р-ром к-ты. Близок к нему гидрооксихинолинмолибдатный
метод -осаждение фосфоромолибдата 8-гидроксихинолином с послед, растворением
в щелочи и кислотным титрованием. Известны методы прямого титрования фосфатов
солями разл. металлов (Ag, Pb, Bi, Ce и др.), а также методы осаждения нерастворимых
фосфатов (Ag, Bi и т. п.) с послед. титримет-рич. определением металлов.
Наиб. употребляемые фотометрич.
методы определения Ф. основаны на р-ции образования желтого фосфоромолибдено-вого
комплекса или его восстановленной формы синего цвета.
Применяют разл. физ. методы
определения Ф.: спектральные, атомно-адсорбционный, люминесцентный, ЯМР, радио-активационный
и др. Для отделения Ф. от др. элементов чаще всего используют экстракционные
методы. Для разделения разл. фосфатных анионов обычно применяют бумажную хро-матографию.
Применение. Осн.
долю всего добываемого Ф. (~ 90%) используют для получения P2O5
и т. наз. термической фосфорной к-ты, применяемой в произ-ве разл. фосфорных
удобрений и разнообразных фосфатов, в т. ч. для животноводства (минеральных
подкормок). Используют Ф. также для получения разнообразных фосфорсодержащих
неорг. и орг. соединений. Белый Ф. применяют в качестве дымообразующего и зажигат.
ср-ва, для изготовления трассирующих боеприпасов.
Красный Ф. используют в
спичечной пром-сти как осн. компонент обмазки зажигат. пов-сти спичечных коробков,
как компонент термопластичных композиций, в произ-ве ламп накаливания - как
газопоглотитель.
В металлургии Ф. применяют
как раскислитель при получении нек-рых сплавов, напр. хромаля, как легирующую
добавку (фосфористый чугун содержит до 0,8% P, нек-рые стали до 0,3% P, фосфористая
бронза до 1,2% P), как компонент припоев и антифрикционных сплавов, магнитомягких
сплавов, для фосфатирования пов-сти стальных изделий с целью увеличения их коррозионной
стойкости, для получения ферромагн. пленок в элементах памяти вычислит. машин.
Ф. высокой чистоты используют для получения полупроводниковых фосфидов, в осн.
типа АIПВ5.
Мировое произ-во Ф. (без
стран СНГ) ок. 1 млн. т в год. Осн. производители - США, Германия, Нидерланды,
Канада.
Белый Ф. очень ядовит -
смертельная доза для человека 0,05-0,15 г. Симптомы острого отравления: желудочно-кишечные
расстройства, сердечная недостаточность. При хро-нич. отравлении происходит
изменение костей, в частности омертвение челюстей. Попадая на кожу, белый Ф.
воспламеняется, давая тяжелые ожоги. ПДК в воздухе рабочей зоны 0,03 мг/м3.
Хранят белый Ф. под слоем воды или незамерзающего р-ра (CaCl2 или
NaCl, ZnCl2) в темноте.
Красный Ф. менее токсичен,
но его пыль может вызывать хронич. отравление, а также пневмонию, поражение
кожи. T. к. красный Ф. может воспламеняться, в частности, при трений и ударе,
разбивать его слитки рекомендуется орудиями из тефлона. Черный Ф. не токсичен,
может обрабатываться без особых предосторожностей.
Ф. получил в 12 в. арабский
алхимик Ахад Бехиль. В Европе Ф. впервые был получен X. Брандом в 1669.
Лит.: Везер В.-Дж.,
Фосфор и его соединения, пер. с англ., M., 1962; Астахов К. В., Фосфор, M.,
1972; Аналитическая химия фосфора, M., 1974; Ершов В. А., Технология производства
фосфора, Л., 1978; Технология фосфора, Л., 1979; Корбридж Д., Фосфор. Основы
химии, биохимии, технологии, пер. с англ., M., 1982; Миллер Т.Н., Витола А.
А., Неорганические соединения фосфора с азотом, Рига, 1986; Физико-химические
и технологические основы процесса получения красного фосфора, M., 1987.
П. И. Федоров.


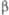 , град
, град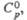 Дж/(моль· К)
Дж/(моль· К)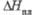 , кДж/моль
, кДж/моль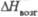 , кДж/моль
, кДж/моль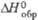 , кДж/моль
, кДж/моль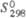 ,Дж/(моль· К)
,Дж/(моль· К)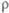 ,Ом· м
,Ом· м