Формальдегид
ФОРМАЛЬДЕГИД (муравьиный
альдегид, метаналь), HCHO, мол. м. 30,3; бесцв. газ с резким раздражающим запахом;
т. пл. -118 0C, т. кип. -19,2 0C; 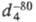 0,9172,
0,9172,
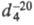 0,8153,
плотн. по воздуху 1,04; tкрит 137,2-141,2 0C, ркрит
6,784-6,637 МПа; ур-ние температурной зависимости давления пара в интервале
от -109 до -220C: lg r (Па) = 9,2817 - 959,437(243,39
+ t);
0,8153,
плотн. по воздуху 1,04; tкрит 137,2-141,2 0C, ркрит
6,784-6,637 МПа; ур-ние температурной зависимости давления пара в интервале
от -109 до -220C: lg r (Па) = 9,2817 - 959,437(243,39
+ t); 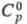 35,4 Дж/(моль · К),
35,4 Дж/(моль · К), 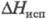 23,31 кДж/моль (19 0C), DH0сгор-561,5 кДж/моль,
23,31 кДж/моль (19 0C), DH0сгор-561,5 кДж/моль,
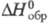 -115,9
кДж/моль,
-115,9
кДж/моль,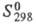 218,8 Дж/(моль · К).
218,8 Дж/(моль · К).
Чистый газообразный Ф.
относительно стабилен при 80-100 0C, при т-рах ниже 80 0C
медленно полимеризуется; процесс ускоряется в присут. полярных р-рителей (в
т.ч. воды), к-т и щелочей.
Ф. хорошо раств. в воде,
спиртах и др. полярных р-рителях. При низких т-рах смешивается в любых соотношениях
с неполярными р-рителями: толуолом, диэтиловым эфиром, этилацетатом, CHCl3
(с увеличением т-ры р-римость падает), не раств. в петролейном эфире. Водные
р-ры Ф. содержат равновесную смесь моногидрата CH2(OH)2
(99,9%), неустойчивого в своб. состоянии, и полимергидратов HO(CH2O)nH
(п = 2-8), устойчивых кристаллич. соединений. При продолжит. хранении
водных р-ров (особенно при низких т-рах) и при их концентрировании степень полимеризации
увеличивается. Для хранения водных р-ров Ф. их стабилизируют метанолом (см.
Формалин). При упаривании водных р-ров в вакууме образуется параформ,
или параформальде-гид (CH2O)n (п = 8-12), при действии
щелочи на конц. водные р-ры - т. наз. a-полиоксиметилен (n > 100).
Полимеризация в неполярном р-рителе приводит к полиформальдегиду (n
> 1000).
Параформ - бесцв. кристаллы
с запахом Ф., т. пл. 120-170 0C, в холодной воде р-ряется медленно,
в горячей -быстро, образуя р-ры Ф., плохо раств. в ацетоне; горюч, т. всп. 720C.
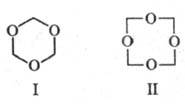
Известны циклич. полимеры
Ф.: триоксан (ф-ла I, т. пл. 64 0C), получаемый перегонкой 60%-ного
водного р-ра Ф. с разб. H2SO4, и тетраоксиметилен (ф-ла
II, т. пл. 112 0C), образующийся при нагр. диацетата высокомол. полиоксиметилена.
Ф. обладает высокой реакционной
способностью. Восстанавливается H2 в присут. многих металлов или
их оксидов (напр., Ni, Pt, Cu) до метанола; окисляется HNO3, KMnO4
до муравьиной к-ты или CO2 и H2O; осаждает мн. металлы
(Ag, Pt, Au, Bi и др.) из р-ров их солей, окисляясь при этом в муравьиную к-ту.
С альдегидами в присут.
сильных щелочей Ф. вступает в т. наз. перекрестную р-цию Канниццаро (C6H5CHO
+ HCHO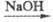 C6H5CH2OH + HCOONa); с ацетальдегидом в присут.
Ca(OH)2 образует пентаэритрит, в паровой фазе при 285 0C
- акролеин; под действием алкоголятов Al или Mg Ф. подвергается диспропорционированию
с образованием ме-тилфомиата (см. Тищенко реакция).
C6H5CH2OH + HCOONa); с ацетальдегидом в присут.
Ca(OH)2 образует пентаэритрит, в паровой фазе при 285 0C
- акролеин; под действием алкоголятов Al или Mg Ф. подвергается диспропорционированию
с образованием ме-тилфомиата (см. Тищенко реакция).
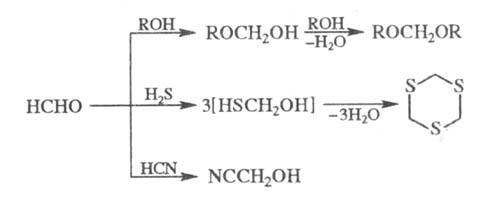
Р-ция Ф. со спиртами в
присут. сильных к-т приводит к ацеталям (формалям), с H2S - к циклич.
тритиану, с HCN в присут. щелочей - к циангидрину:
Ф. присоединяется к олефинам
в присут. кислых катализаторов с образованием 1,3-дигликолей и 1,3-диоксанов
(см. Принса реакция), р-ция Ф. с изобутиленом дает изопрен, жидкофазная
конденсация с пропиленом в присут. BF3 или H2SO4
- бутадиен. Из Ф. и кетена в пром-сти получают b-пропиолактон.
Р-ция Ф. с ацетиленом -
пром. способ получения бутадиена (см. Рeппe реакции), при взаимод. двух
молекул Ф. с ацетиленом образуется 2-бутин-1,4-диол.
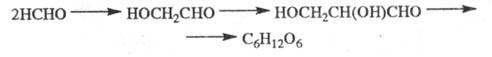
В присут. извести Ф. превращается
в углеводы:
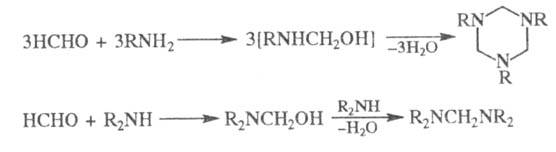
При взаимод. Ф. с NH3
образуется гексаметилентетрамин, с первичными аминами - тримеры, с вторичными
- бис-(ди-алкиламино)метаны:
Соед. с подвижным атомом
водорода реагируют с Ф. и NH3 (или аминами) по Манниха реакции.
Р-ция Ф. с NH4Cl пром. способ получения метиламина: 2НСНО + NH4Cl
 CH3NH2 · HCl + HCOOH (р-ция может идти дальше с образованием
ди- и триметиламинов). С мочевиной в щелочной среде Ф. дает моно- и диметилольные
производные, поликонденсацией к-рых получают мочевино-формальдегид-ные смолы,
а из меламина и Ф.- меламино-формальдегидные смолы.
CH3NH2 · HCl + HCOOH (р-ция может идти дальше с образованием
ди- и триметиламинов). С мочевиной в щелочной среде Ф. дает моно- и диметилольные
производные, поликонденсацией к-рых получают мочевино-формальдегид-ные смолы,
а из меламина и Ф.- меламино-формальдегидные смолы.
Ароматич. соед. (бензол,
анилин, толуол) образуют с Ф. соответствующие диарилметаны; в присут. HCl бензол
хлор-метилируется Ф. по Блана реакции, образуя бензилхлорид; с фенолами в присут.
к-т или оснований Ф. конденсируется с образованием орто- и пара-метилольных
производных, к-рые далее превращаются в феноло-формалъдегидные смолы. Продукты
конденсации Ф. с фенол- и нафталинсульфокислотами используют как дубильные в-ва
(неразол и др.).
В пром-сти Ф. получают
окислит. дегидрированием метанола в паровой фазе O2 воздуха в присут.
Ag при 680-720 0C (конверсия метанола 97-98%) либо в присут. Ag или
серебряной сетки при 600-650 0C (конверсия 77-87%) с возвращением
непрореагировавшего метанола в рецикл. Процесс можно
проводить в избытке воздуха в присут. оксидов металлов (Fe-Mo-V) при 250-400
0C (конверсия 98-99%). Ф. может быть получен окислением метана, пропана,
бутана, этилена, гидрированием СО, однако эти методы не имеют пром. значения
по экономич. причинам.
В лаб. условиях Ф. получают
дегидрированием метанола над медью, термич. разложением формиата цинка, деполимеризацией
параформа.
Дня обнаружения Ф. используют
реагент Шиффа или р-цию Ф. с фенилгидразином и K3[Fe(CN)6]
в щелочной среде (красное окрашивание). Определяют Ф. иодометрически либо применяют
р-цию Ф. с сульфитом Na с послед. титрованием выделившейся щелочи к-той: HCHO+
Na2SO3 HOCH2SO3Na + NaOH, а также жидкостной хроматог-рафией
и др. методами.
HOCH2SO3Na + NaOH, а также жидкостной хроматог-рафией
и др. методами.
Ф. используют в орг. синтезе,
в произ-ве синтетич. смол и пластмасс, для синтеза мн. лек. в-в и красителей,
для дубления кож, как дезинфицирующее, антисептич. и дезодорирующее средство.
Ф. токсичен, вызывает дегенеративные
процессы в паренхиматозных органах. Сильное действие на нервную систему, по-видимому,
связано с наличием примесей метанола в техн. Ф. или превращением Ф. в организме
в метанол и муравьиную к-ту. В то же время считается, что Ф. быстро окисляется
в организме до CO2 (на 70-80%).
ПДК в атм. воздухе 0,003
мг/м3, в воздухе рабочей зоны 0,5 мг/м3, в воде водоемов
хозяйств.-бытового пользования 0,05 мг/л. T. самовоспл. 430 0C, КПВ
при 20 0C 7-72% (по объему).
Мировое произ-во Ф. ок.
5 млн. т в год (1980), из них в США 28%, Германии 17%, Японии 12%.
Лит.: Уокеr
Дж. Ф., Формальдегид, пер. с англ., M., 1957; Walkeг J. F., Formaldehyde, 5
ed., N. Y., 1964; Kirk - Othmer encyclopedia, 3 ed., v. 11, N. Y., 1980,
p. 231-50. В.Н. Розанов.

