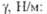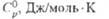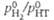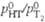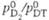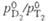Тритий
ТРИТИЙ (от греч.
tritos - третий) T, или 31H, радиоактивный тяжелый изотоп
водорода с мас. ч. 3. Ядро атома Т.- тритон с массой 3,016050 состоит
из одного протона и двух нейтронов, энергия связи 8,1-8,4 МэВ. При b-распаде
T. образуется легкий изотоп гелия: 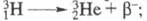 Т1/2 12,33 года; макс. энергия излучения 18,61 кэВ, средняя
- 5,54 кэВ. Уд. активность T. 3,59 · 105 ГБк/г. При взаимод.
Т1/2 12,33 года; макс. энергия излучения 18,61 кэВ, средняя
- 5,54 кэВ. Уд. активность T. 3,59 · 105 ГБк/г. При взаимод. -частиц
T. с в-вом возникает тормозное фотонное излучение, к-рое используют для количеств.
определения T. в разл. средах.
-частиц
T. с в-вом возникает тормозное фотонное излучение, к-рое используют для количеств.
определения T. в разл. средах.
Молекула T. двухатомна,
мол. м. 6,03210; основная частота колебаний атомов 2548,36 см-1;
константа диссоциации 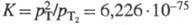 (293,15 К), где p - давление. С др. изотопами
водорода T. образует молекулы прототри-тия HT с мол.м. 4,02395 и дейтеротрития
DT с мол. м. 5,03015. Молекулярный T. может находиться в орто-и пара-состояниях
(соотв. о-Т2 и п-Т2). При обычных условиях газообразный
T2 представляет собой смесь 75% орто- и 25% пара-модификаций (нормальный
Т., н-T2). Равновесный T. (р-Т2), имеющий равновесный
орто-пара-состав при данной т-ре, содержит п-T2, (%): 97,243 (10
К), 66,453 (20 К), 43,493 (30 К), 33,35 (40 К), 28,789 (50 К), 25,075 (100 К).
Энтальпия орто-пара-превращения н-T2 в р-Т2 составляет
-195,94 при 20 К и -11,51 Дж/моль при 50 К.
(293,15 К), где p - давление. С др. изотопами
водорода T. образует молекулы прототри-тия HT с мол.м. 4,02395 и дейтеротрития
DT с мол. м. 5,03015. Молекулярный T. может находиться в орто-и пара-состояниях
(соотв. о-Т2 и п-Т2). При обычных условиях газообразный
T2 представляет собой смесь 75% орто- и 25% пара-модификаций (нормальный
Т., н-T2). Равновесный T. (р-Т2), имеющий равновесный
орто-пара-состав при данной т-ре, содержит п-T2, (%): 97,243 (10
К), 66,453 (20 К), 43,493 (30 К), 33,35 (40 К), 28,789 (50 К), 25,075 (100 К).
Энтальпия орто-пара-превращения н-T2 в р-Т2 составляет
-195,94 при 20 К и -11,51 Дж/моль при 50 К.
T. образуется в верх. слоях
атмосферы в результате взаимод. космич. излучения гл. обр. с ядрами N и O, напр.:
 . Образующиеся
таким образом атомы T. в результате р-ций радиац. окисления и изотопного обмена
переходят в молекулы воды, затем T. в составе дождевой воды выпадает на пов-сть
Земли. По совр. оценкам, равновесная активность космогенного T. во внеш. среде
(гидросфере и атмосфере) составляет (1,11-1,30)·109 ГБк (3,0-3,5
кг). Считают, что ок. 90% природного T. содержится в гидросфере (гл.
обр. в виде НТО), 10% в стратосфере (НТО) и 0,1% и тропосфере (из них
50% в виде HT).
. Образующиеся
таким образом атомы T. в результате р-ций радиац. окисления и изотопного обмена
переходят в молекулы воды, затем T. в составе дождевой воды выпадает на пов-сть
Земли. По совр. оценкам, равновесная активность космогенного T. во внеш. среде
(гидросфере и атмосфере) составляет (1,11-1,30)·109 ГБк (3,0-3,5
кг). Считают, что ок. 90% природного T. содержится в гидросфере (гл.
обр. в виде НТО), 10% в стратосфере (НТО) и 0,1% и тропосфере (из них
50% в виде HT).
Большое кол-во T. образуется
при ядерных и, гл. обр., термоядерных взрывах. Взрыв водородной бомбы с тротиловым
эквивалентом 1 MT приводит к выделению (2,6-7,4)*108 ГБк трития.
С начала испытания термоядерною оружия (1954) содержание T. в дождевой воде
возросло с 0,5-5,0 до 500 T.E.: T.E. - тритиевая единица, равная отношению числа
атомов Т/Н = 10-18, или 0,12 Бк на 1 л воды. При подземных ядерных
взрывах T. также превращ. в оксид и частично выходит на пов-cть. По оценкам
(1970), общее содержание T. в биосфере: в мировом океане 250 кг, в континентальных
водах 45 кг, в воздухе 3 кг.
Свойства. Нек-рые
св-ва T. приведены в табл. 1. Ур-ние температурной зависимости давления насыщ.
пара жидкого н-Т2 в интервале 25-40 К: 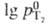 (гПа) = 6,158 +78,925/T+2*10-4(T-25)2.
(гПа) = 6,158 +78,925/T+2*10-4(T-25)2.
Tабл. 1. - СВОЙСТВА
HT, DT и н-Т2
|
Показатель |
HT |
DT |
н-T2 |
|
tкрит,
K |
37,13 |
39,42 |
40,44 |
|
|
1,571 |
1,773 |
1,850 |
|
Т-ра тройной точки,
К |
17,62 |
19.71 |
20,62 |
|
T. кип., К |
22,92 |
24,38 |
25,04 |
|
AHисп
при т. кип., Дж/моль |
— |
— |
1394 |
|
Плотн. жидкости
(кг/м3) вдоль линии
насыщения: |
|
|
|
|
21 К |
162.8 |
220,7 |
272,2 |
|
23 К |
157,S |
214,6 |
265,0 |
|
25 К |
152,3 |
208.1 |
257,3 |
|
|
|
|
|
|
21 К |
3,035 |
3,793 |
4,181 |
|
23 К |
2,607 |
3,327 |
3,694 |
|
25 К |
2,180 |
2,860 |
3,207 |
|
|
29,198 |
29,195 |
29,199 |
Давление пара HT м.
б. вычислено по ф-ле: 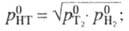 аналогично принято,
что
аналогично принято,
что 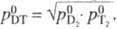 Коэф.
диффузии HT в жидком H2 м.б. вычислен по
ур-нию D = 3,05*10-4exp(-36/T). Идеальный коэф. разделения
изотопов водорода
при равновесии жидкость-пар
Коэф.
диффузии HT в жидком H2 м.б. вычислен по
ур-нию D = 3,05*10-4exp(-36/T). Идеальный коэф. разделения
изотопов водорода
при равновесии жидкость-пар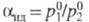 (см.
табл. 2). Эксперим. коэф.
разделения смесей D2-DT и D2-T2 на 5-6% ниже
(см.
табл. 2). Эксперим. коэф.
разделения смесей D2-DT и D2-T2 на 5-6% ниже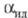 Р-ции изотопного обмена
водорода
Р-ции изотопного обмена
водорода  и
и (константы
равновесия при 298,15 К равны соотв. 2,57 и 3,82) протекают
вследствие выделения энергии при радиоактивном распаде Т., скорость
их зависит от концентрации Т., а также от присутствия катализаторов.
T. окисляется O2 при обычной т-ре и без катализаторов вследствие
(константы
равновесия при 298,15 К равны соотв. 2,57 и 3,82) протекают
вследствие выделения энергии при радиоактивном распаде Т., скорость
их зависит от концентрации Т., а также от присутствия катализаторов.
T. окисляется O2 при обычной т-ре и без катализаторов вследствие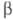 -распада.
-распада.
Табл.2.- ЗНАЧЕНИЯ
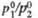
|
Т-ра, К |
|
|
|
|
|
21,0 22,0 23,0
24,0 |
2,19 2,06 1,95
1,86 |
2,18 2,05 1,94 |
1,30 1,27 1,25
1,23 |
1,690 1,613 1,563
1,513 |
Оксиды трития T2O
(мол.м. 22,03150), прототрития НТО (20,02335) и дейтеротрития DTO (21,02955)
имеют уд. активность соотв. 98050, 53650 и 51430 ГБк/г. Для T2O т.
кип. 274,70 К, т-ра тройной точки
277,64 К; плотн. 1,21459 г/см3 (293,15 К), макс. плотн. 1,21502 (286,55
К); отношение значений давления паров H2O и T2O в интервале
264-387 К: 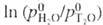 = -103,87/Т+ 46480/Т2.
= -103,87/Т+ 46480/Т2.
Давление пара НТО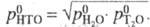 Коэф. разделения жидкость - пар (относит, летучесть
Коэф. разделения жидкость - пар (относит, летучесть 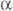 )
р-ров DTO в D2О в интервале 313,15-373,15 К:
)
р-ров DTO в D2О в интервале 313,15-373,15 К: 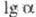 =8,026/7+0,0198.
Коэф. диффузии (м2/с) при 298,15 К: НТО в H2O 2,236-10-9,
DTO в D2O 1,849*10-9, DTO в НТО 2,029*10-9.
=8,026/7+0,0198.
Коэф. диффузии (м2/с) при 298,15 К: НТО в H2O 2,236-10-9,
DTO в D2O 1,849*10-9, DTO в НТО 2,029*10-9.
Константы равновесия К
изотопного обмена H2O+ и D2O +
и D2O + при 300 К соотв. равны
3,699 и 3,972. Образование НТО может происходить при изотопном обмене
при 300 К соотв. равны
3,699 и 3,972. Образование НТО может происходить при изотопном обмене 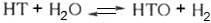 ,
К = 6.31 (300 К).
,
К = 6.31 (300 К).
В результате радиоактивного
распада T. в его соед. имеют место радиац. эффекты. Вода, содержащая Т., подвергается
радиолизу с образованием H2 и H2O2. Вода, содержащая
100% Т., разлагается на 50% через 5,24 сут. Рекомендуемая Международной
комиссией радиологич.
зашиты условная граница допустимого содержания T. в воде (при к-ром практически
не наблюдается ее саморазложение) 3,7*103 ГБк/л.
Тритиды подобны гидридам
(незначит. отличия проявляются в
таких св-вах, как плотность и параметры кристаллич.решетки): получают
их теми же методами, что и гидриды. Наиб. важны LiT (Li2DT), TiT2,
ZrT2, UT3. Обьем (см3) T2, связываемого
1 г металла: Li 1,6*103, Ti 4,7*102, Zr2,5-102,
U 1,4*102.
В любом водородсодержащем соед. замещение одного атома H на атом T приводит
к образованию соед. с уд. активностью 107,7-104 ГБк/моль.
Получение. В пром.
масштабе T. получают в ядерном реакторе, облучая Li, чаще всею обогащенный изотопом
6Li, нейтронами:  . Продукт естеств. распада Т.- 3Не - также вступает в ядерную р-цию,
превращаясь в T. и протий:
. Продукт естеств. распада Т.- 3Не - также вступает в ядерную р-цию,
превращаясь в T. и протий:  .
Получение T. включает подготовку материала
к облучению, проведение облучения и накопление T. в материале, выделение, очистку
и концентрирование, при
этом используют методы термодиффузии и низкотемпературной ректификации.
T. может быть также получен выделением и концентрированием
при изотопной очистке тяжелой воды - замедлителя
ядерных реакторов. Этим путем на установке в Гренобле (Франция) получают 8,88-106
ГБк в год 98%-ного T. Установка TRF (Tritium Removal Facility) в Канаде, рассчитанная
на переработку 350 кг/ч D2O тяжеловодных реакторов, по аналогичной
технологии позволяет
получать ок. 109 ГБк в год T. чистотой не менее 99%. Хранить T. можно
в виде тритидов.
.
Получение T. включает подготовку материала
к облучению, проведение облучения и накопление T. в материале, выделение, очистку
и концентрирование, при
этом используют методы термодиффузии и низкотемпературной ректификации.
T. может быть также получен выделением и концентрированием
при изотопной очистке тяжелой воды - замедлителя
ядерных реакторов. Этим путем на установке в Гренобле (Франция) получают 8,88-106
ГБк в год 98%-ного T. Установка TRF (Tritium Removal Facility) в Канаде, рассчитанная
на переработку 350 кг/ч D2O тяжеловодных реакторов, по аналогичной
технологии позволяет
получать ок. 109 ГБк в год T. чистотой не менее 99%. Хранить T. можно
в виде тритидов.
Применение. Т.-
компонент топлива для термоядерного синтеза:  МэВ: радиоактивный изотопный индикатор в химии, биологии, медицине, геофизике,
гидрогеологии и др.
В виде тритиевых мишеней (тритиды U,
Ti, Zr, интерметаллиды) используется в генераторах нейтронов, детекторах для
газо-жидкостной хроматографии, в качестве радиоактивных источников излучения
для флюорографии, в
толщиномерах и т.д. T. применяют при изготовлении световых указателей
и сигналов (активированный ZnS излучает зеленоватое свечение в присутствии Т.).
МэВ: радиоактивный изотопный индикатор в химии, биологии, медицине, геофизике,
гидрогеологии и др.
В виде тритиевых мишеней (тритиды U,
Ti, Zr, интерметаллиды) используется в генераторах нейтронов, детекторах для
газо-жидкостной хроматографии, в качестве радиоактивных источников излучения
для флюорографии, в
толщиномерах и т.д. T. применяют при изготовлении световых указателей
и сигналов (активированный ZnS излучает зеленоватое свечение в присутствии Т.).
Техника безопасности
и контроль. Макс. пробег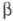 -частиц
T. в воздухе 5,8 мм при 20 0C, в биол. ткани 6,5 мкм. Поэтому
-частиц
T. в воздухе 5,8 мм при 20 0C, в биол. ткани 6,5 мкм. Поэтому 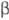 -частицы T. полностью поглощаются роговыми слоями кожи и внеш. облучение организма
T. и его соед. не представляет опасности. T. опасен при попадании в организм
через кожу, легкие или при приеме пищи и воды. Период полувыведения T. при поглощении
в виде газа 3,3 мин, а в виде воды 10-12 сут. Независимо от путей поступления
в организм через 2-3 ч наблюдается равномерное распределение НТО в жидкой фазе
организма (кровь, моча, выдыхаемые пары воды). Для газообразного T. и НТО (T2O)
категория радиац. опасности Г, минимально
значимая активность 3,7 · 106 Бк. Допустимые концентрации
T. в воздухе рабочей зоны ДКА и в атм. воздухе или воде ДКБ,
предельно допустимое поступление через органы дыхания ПДП, предел годового поступления
в организм ПГП приведены в табл. 3.
-частицы T. полностью поглощаются роговыми слоями кожи и внеш. облучение организма
T. и его соед. не представляет опасности. T. опасен при попадании в организм
через кожу, легкие или при приеме пищи и воды. Период полувыведения T. при поглощении
в виде газа 3,3 мин, а в виде воды 10-12 сут. Независимо от путей поступления
в организм через 2-3 ч наблюдается равномерное распределение НТО в жидкой фазе
организма (кровь, моча, выдыхаемые пары воды). Для газообразного T. и НТО (T2O)
категория радиац. опасности Г, минимально
значимая активность 3,7 · 106 Бк. Допустимые концентрации
T. в воздухе рабочей зоны ДКА и в атм. воздухе или воде ДКБ,
предельно допустимое поступление через органы дыхания ПДП, предел годового поступления
в организм ПГП приведены в табл. 3.
В ядерных реакторах, работающих
на тепловых нейтронах, в результате побочных процессов образуется Т., к-рый
может попадать в окружающую среду с газообразными или жидкими отходами, как
непосредственно на АЭС, так и при дальнейшей переработке
облученного ядерного топлива. Количеств. оценка поступления T. в окружающую
среду с газообразными и жидкими отходами АЭС, ГБк/МВт(электрич.)*год: реакторы
ВВЭР (водно-водяной
энергетич. реактор) - в атмосферу 7,4-33,
в гидросферу 33; реакторы РБМК (реактор большой мощности
канальный) - соотв. 22 и 1,5. Существенно более высокие выбросы T. наблюдаются
на АЭС с тяжеловодными реакторами.
Осн. источник поступления T. в окружающую среду в ядерной технологии - заводы
по переработке ядерного топлива. Так, напр., завод по переработке ядерного топлива
с производительностью 1500 т UO2 в год м.б. источником T.-
(1,11-2,96)·1016 Бк в год.
Табл. 3.- ЗНАЧЕНИЯ ДОПУСТИМЫХ
КОНЦЕНТРАЦИЙ ТРИТИЯ
| Дтя категории А: |
|||
|
Состояние T. |
Критич. орган |
ПДП, Бк/год |
ДКА,
Бк/л |
|
Газ |
Все тело |
5.55 ·1012 |
22,2 ·105 |
|
НТО (T2O) |
Все тело |
4,4·108 |
3,7 · 102 |
| Для категории Б: |
|||
|
Состояние T. |
Критич. орган |
ПДП, Бк/год через
органы дыхания |
ДКК,
Б к/л |
|
в атм. воздухе
в воде |
|||
|
Газ |
Все тело |
.5,55 ·1011 |
7,4·104
— |
|
НТО (T2O) |
Все тело |
7,4·107 |
11,1 14,8 · 104 |
Эксплуатация термоядерных
энергетич. установок будущего приведет к дальнейшему росту выбросов Т., т.к.
ТЯЭС (термоядерная энергетич. станция) по оценкам будет выделять T. в 104-106
раз больше, чем АЭС эквивалентной мощности. Задачи улавливания T. и очистки
сбросов до санитарных норм, выделения и концентрирования T. с целью его локализации
(захоронения) или использования м. б. решены при помощи методов разделения изотопов
водорода: ректификацией воды под вакуумом, хим. изотопным обменом (очистка и
начальное концентрирование), низкотемпературной ректификацией
жидкого водорода, сорбционным разделением на твердых сорбентах. Содержание
T. в разл. средах определяют измерением его активности чаще всего ионизационными
и сцинтилляционными методами
(табл. 4). При недостаточной чувствительности измерит, аппаратуры
применяют методы предварит, концентрирования (термодиффузия,
ректификация, электролиз).
Табл. 4.- ХАРАКТЕРИСТИКА
НАИБОЛЕЕ УПОТРЕБЛЯЕМЫХ МЕТОДОВ ОПРЕДЕЛЕНИЯ ТРИТИЯ
|
Детектор |
Миним. детектируемая
активность Т., Бк |
Пределы измерения
концентрации T. в воде, Бк/л |
|
Пропорциональный счетчик |
3,7·10-2 |
3,7·(10-106) |
|
Счетчик Гейгера- Мюллера |
3,7·10-2 |
18,5- 3,7·105 |
|
Жидкостной сцинтилляц.
счетчик совпадений |
0,37 |
1,85·102-3,7·108 |
|
Ионизац. камера |
3,7· I02 |
1,85·105-3,7·1014 |
Для контроля за содержанием T. в воздухе используют ионизац. камеры [диапазон измеряемых концентраций 3,7·(10-1013) Бк/л], пропорциональные (1,85-3,7·106 Бк/л) и сцинтилляц. счетчики [3,7·(10-1O7) Бк/л], для периодич. контроля - фотопленки. T. открыли в 1934 Э. Резерфорд, M. Олифант и П. Хартек.
Лит.:
Ленский Л. А., Физика и химия трития, M., 1981; Беловодский
Л.Ф., Гаевой В. К., Гришмановский В. И., Тритий, M., 1985; Андреев Б. M., Зельвенский
Я.Д., Катальников С.Г., Тяжелые изотопы водорода в ядерной технике, M., 1987;
Вредные химические вещества. Радиоактивные вещества. Справочник, под ред. Л.
А. Ильина, В. А. Филова, Л.,
1990, с. 50-57. Я. Д. Зельвенский.


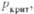 МПа
МПа