Тантал
ТАНТАЛ (по имени
героя др.-греч. мифологии Тантала, осужденного на вечную неутолимую жажду; назван
так из-за трудности получения его в чистом виде; лат. Tantalum)Ta, хим. элемент
V гр. периодич. системы, ат. н. 73, ат. м. 180,9479. В природе два изотопа:
стаб. 181Та (99,9877%) и радиоактивный 180Та (0,0123%,
b-излучатели, Т1/2 1·1013 лет). Поперечное
сечение захвата тепловых нейтронов 2,13·10-27 м2. Конфигурация
внеш. электронных оболочек атома 5s25р65d36s2;
степень окисления +5, значительно реже + 4, +3 и +2; энергии ионизации Та0
: Та+ : Та2+ соотв. 7,89 и 16,2 эВ;
электроотрицательность по Полингу 1,5; атомный радиус 0,146 нм, ионные радиусы,
нм (в скобках указаны координац. числа): Та3+ 0,086(6), Та4+
0,082(6), Та5+ 0,078 (6), 0,083 (7), 0,088(8).
Содержание Т. в земной
коре 2,5·10-4% по массе. Встречается в природе обычно вместе с Nb.
Входит в состав неск. десятков минералов, представляющих собой тантало-нио-баты
или титано-тантало-ниобаты. Важнейшие из них-колумбит-танталит и пирохлор (см.
Ниобии), микролит-разновидность пирохлора с содержанием 55-74%
Та2О5. Т. содержится также в касситерите (см. Олово),
при переработке к-рого Т. переходит в шлаки восстановит. плавки (11-15%,
иногда до 30% Та2О5). Месторождения Т. имеются в Нигерии,
Канаде, Бразилии, СНГ, Австралии, Заире, Малайзии, Мозамбике и Таиланде. Общие
мировые запасы Т. в 1980 оценивались в 254 тыс. т, в пром. месторождениях-ок.
65, 3 тыс. т.
Свойства. Т.-блестящий
серебристо-серый металл; кри-сталлич. решетка кубическая объемноцентрированная,
а = 0,3296 нм, z = 2, пространств. группа Iт3т. Т.
пл. 3014°С, т. кип. ок. 5500°С; плотн. 16,60 г/см3 (20°С);
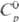 25,39 Дж/(моль · К); DHпл 34,8 кДж/моль (3287 К),
25,39 Дж/(моль · К); DHпл 34,8 кДж/моль (3287 К), 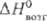 787 кДж/моль (298 К),
787 кДж/моль (298 К), 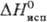 751
кДж/моль (5773 К);
751
кДж/моль (5773 К); 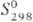 41,6 Дж/(моль·К); т-ра перехода в сверхпроводящее состояние 4,45 К; ур-ние температурной
зависимости давления пара: lgp(Па) = 13,98-41600/T-lgT
(2200-3263 К); температурный коэф. линейного расширения 6,5·10-6
К-1 (293--393 К) и 8,0·10-6 K-1 (293-1773
К); теплопроводность 54,43
Вт/(м·К) при 293 К; rl,32·10-7(0°C) и 8,7· 10-7
Ом·м (2000°С), температурный коэф. r 3,82·10-3 К-1
(0-100°С). Т. парамагнитен, уд. магн. восприимчивость +9,49·10-7 (18°С).
Имеет очень малую величину работы выхода электронов (6,60·10-19 Дж).
41,6 Дж/(моль·К); т-ра перехода в сверхпроводящее состояние 4,45 К; ур-ние температурной
зависимости давления пара: lgp(Па) = 13,98-41600/T-lgT
(2200-3263 К); температурный коэф. линейного расширения 6,5·10-6
К-1 (293--393 К) и 8,0·10-6 K-1 (293-1773
К); теплопроводность 54,43
Вт/(м·К) при 293 К; rl,32·10-7(0°C) и 8,7· 10-7
Ом·м (2000°С), температурный коэф. r 3,82·10-3 К-1
(0-100°С). Т. парамагнитен, уд. магн. восприимчивость +9,49·10-7 (18°С).
Имеет очень малую величину работы выхода электронов (6,60·10-19 Дж).
Примеси H, N,
С и О снижают пластичность и повышают твердость Т. Чистый Т. легко обрабатывается
давлением на холоду; жаропрочен; sраст при 293 К отожженного
образца высокой чистоты 280-330 МПа, неотожженного 600-1400 МПа; относит. удлинение
отожженного и неотожженного образцов соотв. 20-35 и 2-20%; твердость по Бринеллю
чистого отожженного образца 500 МПа. Т. не переходит в хрупкое состояние до
— 211°С.
Химически Т. очень инертен.
В компактном виде начинает окисляться на воздухе выше 300 °С, устойчив к
действию сухих Вr2 и I2 при 150°С, взаимод. с Сl2
выше 200 °С (см. Тантала галогениды), с Н2-выше
250 °С (интенсивно-при 300 °С), с Р2-выше 250 °С, с С
и углеводородами-при 800-1100 °С. Ниже 150°С не раств. в царской водке,
при обычной т-ре-в соляной, фосфорной и серной к-тах, не реагирует с большинством
др. к-т, водным NH3, водными р-рами солей, орг. в-вами.
Не взаимод. с разб. р-рами щелочей, но медленно раств. в их конц. горячих р-рах.
Устойчив к большинству расплавл. металлов (Li, Na, К, Си, Cd, Hg, Sn, Pb, Bi),
но корродирует в расплавл. Fe, Ni и Со. Раств. во фтористоводородной к-те, ее
смесях с HNO3, в горячих конц. H2SO4 и Н3РО4,
в расплавл. щелочах и NH4HF2.
На воздухе Т. покрывается
тончайшей пленкой тантала оксидов. Обратимо поглощает Н2 с
образованием твердого р-ра внедрения (до 30 ат. %Н) и гидрида состава Та2Н
(тетрагон. кристаллич. решетка, а = 0,338 нм, с = 0,341 нм). Р-римость
Н2(мг в 100 г Т.) меняется от 417 при 17 °С до 6,66 при 1300°С,
выше 1500 °С-близка к нулевой. Макс. содержанию растворенного Н2
соответствует ф-ла ТаН0,78. Гидриды Т. образуются также при электролизе
к-т с катодом из Т., при восстановлении Та2О5 гидридом
Са; при взаимод. ТаСl5 с C6H5MgBr в атмосфере
Н2 получены ТаН, ТаН2 и ТаН3. Гидрирование
Т. и дегидрирование при нагр. используют для Получения мелкодисперсного Т.
При взаимод. с углем Т.
дает карбиды Та2С и ТаС. В системе Та-С установлено существование
трех фаз: a (твердый р-р С в Т) и с недостатком С (структуры вычитания)-b(Та2С)
и g(ТаС). При 150°С Т. растворяет 0,02% по массе С; при содержании
С в Та до 2,46% присутствуют a- и b-фазы, при содержании 2,46-3,21%-Та2С
(ТаС0,38 - 0,50), в области концентраций С 3,21-3,71%
-b- и g-фазы, в области 3,71-5,7%-ТаС (ТаС0,58_0,91).
Параметры кристаллич. решетки гексагон. b-фазы изменяются в пределах: а
= 0,31030-0,31044 нм, с = 0,49367-0,49430 нм; кубич. гранецентрир.
g-фазы-в пределах 0,44206-0,44564 нм. Для Та2С: плотн. 15,22
г/см3; 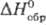 -
208,7 кДж/моль;
-
208,7 кДж/моль; 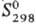 81,7 ДжДмоль-К). Золотисто-желтый монокарбид ТаС имеет т. пл. ок. 3800 °С;
плота. 14,4 г/см3;
81,7 ДжДмоль-К). Золотисто-желтый монокарбид ТаС имеет т. пл. ок. 3800 °С;
плота. 14,4 г/см3;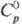 36,8
Дж/(моль · К);
36,8
Дж/(моль · К); 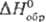 - 142 кДж/моль;
- 142 кДж/моль; 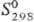 42,4
Дж/(моль · К); весьма устойчив
к хим. реагентам; на воздухе ниже 1000°С не окисляется; раств. только в
смеси HF-HNO3; при нагр. реагирует с N2 и NH3,
образуя нитриды.
42,4
Дж/(моль · К); весьма устойчив
к хим. реагентам; на воздухе ниже 1000°С не окисляется; раств. только в
смеси HF-HNO3; при нагр. реагирует с N2 и NH3,
образуя нитриды.
В системе Ta-N существуют
4 фазы (нитриды): b(TaN0,05), g(TaN0,40_0,45),
d(TaN0,8_0,9) и e (TaN). b-Фаза имеет кубич.
кристаллич. решетку (а = 0,3369 нм;, остальные-гексагональную с параметрами:
для g-фазы а = 0,3041-0.3048 нм, с = 0,4907-0,4918 нм; для
d-фазы а = 0,2925-0,2938 нм, с = 0,2876-0,2883 нм; для e-фазы
а = 0,518 нм, с = 0,2908 нм. При нагр. до 2800-3000 °С нитриды
Т. теряют азот, превращаясь в a-фазу (р-р азота в Т.). Нитриды Т. очень
устойчивы к действию разл. хим. в-в. TaN голубовато-серого или черного цвета;
плотн. 14,36 г/см3;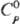 42,7
ДжДмоль · К); D
42,7
ДжДмоль · К); D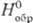 - 252,7 кДж/моль;
- 252,7 кДж/моль; 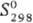 41,9 Дж/(моль·К). Нитриды TaN и Ta2N образуют твердые р-ры соотв.
с ТаС и Та2С. Описана фаза Ta3N5 (красного
цвета), образующаяся при взаимод. Та2О5 с NH3 при
860-920 °С в присут. Ti. Она кристаллизуется в тетрагон. сингонии (а
= 1,02265 им, с = 0,3898 нм, z = 4); плотн. 9,85 г/см3.
При высоком давлении N2 получают Ta5N6.
41,9 Дж/(моль·К). Нитриды TaN и Ta2N образуют твердые р-ры соотв.
с ТаС и Та2С. Описана фаза Ta3N5 (красного
цвета), образующаяся при взаимод. Та2О5 с NH3 при
860-920 °С в присут. Ti. Она кристаллизуется в тетрагон. сингонии (а
= 1,02265 им, с = 0,3898 нм, z = 4); плотн. 9,85 г/см3.
При высоком давлении N2 получают Ta5N6.
С фосфором Т. образует
фосфиды ТаР и Та2Р, с As-ap-сениды TaAs и TaAs2, с Sb-антимониды
Ta3Sb, Ta5Sb4, TaSb2, с S-сульфиды
TaS3 и TaS2.
Известно 4 устойчивых кристаллич.
силицида: TaSi2 (т. пл. ок. 2200°С, гексагон. кристаллич. решетка,
а = 0,4781 ям, с = 0,6534 нм, плота. 9,14 г/см3), Ta5Si3
(т. пл. ок. 2500 °С, имеет две тетрагон. кристаллич. модификации, для низкотемпературной
а = 0,6516 нм, с = 1,1872 нм), Ta2Si (т. пл. ок. 2450
°С, тетрагон. кристаллич. решетка, a = 0,6157нм, с = 0,5039
нм) и Ta9Si2 (т. пл. ок. 2500 °С, гексагон. кристаллич.
решетка, a = 0,6105нм, с = 0,4918 нм). Компактный TaSi2 устойчив
к окислению на воздухе до 1000 °С и выше. Взаимод. с фтористоводородной
к-той и расплавл. щелочами, устойчив к действию др. минеральных к-т и разб.
р-ров щелочей.
С бором Т. образует бориды
ТаВ2 (т. пл. ок. 3200°С), ТаВ (т. пл. ок. 2000 °С), а также
инконгруэнтно плавящиеся Та2В, Та3В2, Та3В4.
Бесцв. сульфат Ta2(SO4)5
гидролизуется водой, при нагр. выше 100°С разлагается с выделением SO3.
Выделены также Ta2O4SO4·3H2O и соли
типа (NH4)3Та(SO4)4. Фосфаты Т.
имеют состав Та3(РО4)5 и ТаОРО4.
Возможно существование гидрофосфатов, а также пирофосфата (ТаО2)4Р2О7.
Соли гилотетич. танталовых к-т- танталаты получают спеканием Та2О5
с оксидами металлов. См. также Танталорганические соединения.
Получение. Большую
часть Т. получают из пирохлоровых и танталит-колумбитовых концентратов и из
шлаков оловянной плавки. Руды обогащают гравитац. методами и флотацией, а также
электромагн. или радиометрич. сепарацией. Содержание Та2О5
и Nb2O5 в концентратах достигает 50%. Концентраты и шлаки
перерабатывают преим. до Та2О5 иди K2[TaF7]
(значительно реже до ТаС15), из к-рых затем получают металлические
Т. Концентраты и шлаки подвергают выщелачиванию действием фтористоводородной
к-ты с послед. очисткой; Nb и Та разделяют экстракцией трибутилфосфатом, циклогексаноном
или метилизобутил-кетоном, реже-др. экстрагентами. Из водной фазы действием
водным NH3 осаждают гидроксид Т. (к-рый сушат и прокаливают до Та2О5)
или действием KF осаждают K2TaF7.
По хлоридному способу концентрат
смешивают с углем или коксом, брикетируют и хлорируют брикеты в шахтной печи
при 700-800 °С или фторируют непосредственно смесь мелкоизмелъченных концентрата
и кокса в солевом хлорид-ном расплаве, содержащем NaCl и КС1. Далее конденсируют
образовавшиеся летучие пентахлориды Nb и Та, разделяют и очищают ректификацией.
Оксид Та2О5 получают гидролизом ТаС15 с послед.
прокаливанием осадка гидрок-сида Т. Иногда хлорированию подвергают феррониобий
или отходы металла.
По сульфатному способу
концентраты обрабатывают конц. H2SO4 или ее смесью с (NH4)2SO4
при 150-300 °С, выщелачивают сульфаты водой, отделяют осадок, разделяют
и очищают Та и Nb экстракцией из фторидных сред, а затем выделяют Та2О5
или K2TaF7. Разрабатывают способы экстракционного разделения
Та и Nb непосредственно из сульфатных р-ров.
Металлические Т. получают
натриетермич. восстановлением K2TaF7 или электролитич.
восстановлением из расплава K2TaF7-Ta2O5-KF-KCl.
После отмывки полученного порошка Т. от примесей его брикетируют, спекают в
штабики, к-рые переплавляют в вакууме в электродуговых и электроннолучевых печах.
Металлические Т. можно
получить восстановлением Та2О5-карботермически, алюмотермически
или нагреванием в смеси с ТаС в вакууме при 2700 °С.
Описаны спосрбы переработки
концентратов Т. с использованием жидких или газообразных фторирующих реагентов.
Мировое произ-во (в развитых
странах) Т. в виде металла и сплавов ок. 700 т (1985); в т.ч. 2/3
из шлаков оловянной плавки.
Определение. Для
определения Т. применяют те же методы, что и для ниобия. Главная трудность-сходство
хим. св-в Nb и Та, проявление эффекта "потери индивидуальности"
Т. в присут. Nb и Ti. Для разделения этих элементов применяют осаждение Т. из
р-ров таннином, экстракцию, напр. кетонами из р-ров в смеси к-т HCl-HF, купфероном
и др., хроматографич. методы. Количественно Т. определяют колориметрически (с
использованием пирогаллола и др.), гравиметрически, люминесцентным, рентгеноспект-ральными,
флуоресцентными, спектральными и нейтрон-но-активационным методами.
Применение. Ок.
35-45% производимого Т. используют в виде порошка для электролитич. конденсаторов
и при произ-ве деталей электронных приборов, ок. 20-25%-в виде карбидов (ТаС
входит в состав нек-рых твердых сплавов; см. Тантала сплавы), ок.
15-20%-в виде проката, а также присадок к сплавам (напр., добавка Т. в нержавеющие
стали повышает их коррозионную устойчивость), ок. 3-6%-в виде оксидов для ферросплавов.
Из Т. изготовляют аноды, сетки, катоды и др. детали электронных ламп, его применяют
в качестве геттера. В хим. пром-сти Т. служит материалом теплообменников, нагревателей,
зондов для измерения т-ры, кислотоупорной облицовки аппаратов. Из Т. изготовляют
тигли для вакуумного напыления и плавки металлов, фторидов и оксидов. Т.-уникальный
биосовместимый материал, в медицине его используют для костного протезирования.
Нитрид TaN применяют в виде устойчивых к истиранию покрытий, ТаSi2-при
изготовлений структур металл-оксид-полупроводник, защитных и нротивоотражательных
покрытий. См. также Лития танталат.
Т. открыт в 1802 А. Экебергом.
В виде пластичного металла впервые получен в 1905 В. Болтоном.
Лит.: Константинов
В. И., Электролитическое получение тантала, ниобия и их сплавов, М., 1977; West
wood W. D., Waterhouse N., Wi Icox P. S, Tantalum thin films, L·, 1975. См.
также лит. при ст. Ниобий.
Э. Г. Раков, М. В. Мелкумянц.

