Висмута оксиды
ВИСМУТА ОКСИДЫ. Сесквиоксид Bi2O3-единственный
устойчивый при нагр. на воздухе В. о. Существует в двух стабильных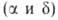 и двух метастабильных (
и двух метастабильных (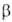 и
и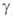 ) модификациях
(см. табл.). Для
) модификациях
(см. табл.). Для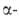 Bi2O3:
плотн. 8,9 г/см3; С°р 114 Дж/(моль*К);
Bi2O3:
плотн. 8,9 г/см3; С°р 114 Дж/(моль*К);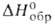 - 578 кДж/моль; So298 151,6 Дж/(моль*К); теплопроводность
~ 0,8 Вт/(м*К);
- 578 кДж/моль; So298 151,6 Дж/(моль*К); теплопроводность
~ 0,8 Вт/(м*К);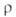 (Ом*см); 2,34*108 (225°С), 1,44*105 (424°С), 6,01*103
(650
°С); полупроводник р-типа.
(Ом*см); 2,34*108 (225°С), 1,44*105 (424°С), 6,01*103
(650
°С); полупроводник р-типа.
Полиморфные превращ. Bi2O3 сопровождаются выделением
или поглощением О2 и поэтому зависят от давления О2.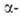 Форма
характеризуется полной занятостью узлов кислородной подрешетки, при нагр.
частично теряет кислород; при ~727°С превращ. в
Форма
характеризуется полной занятостью узлов кислородной подрешетки, при нагр.
частично теряет кислород; при ~727°С превращ. в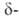 форму
Bi2O3_x (x = = 0,045-0,37),
форму
Bi2O3_x (x = = 0,045-0,37),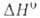 перехода 41 кДж/моль; т. пл. 825 С; плотн. 8,2 г/см3;
перехода 41 кДж/моль; т. пл. 825 С; плотн. 8,2 г/см3;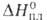 16,3 кДж/моль. Нагретая в среде кислорода
16,3 кДж/моль. Нагретая в среде кислорода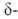 форма
(имеет вакантные узлы кислородной подрешетки) при охлаждении поглощает
О2, а при 635 °С превращ. в
форма
(имеет вакантные узлы кислородной подрешетки) при охлаждении поглощает
О2, а при 635 °С превращ. в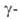 форму
(Bi2O3+x), представляющую собой твердый р-р кислорода
в Bi2O3.
форму
(Bi2O3+x), представляющую собой твердый р-р кислорода
в Bi2O3.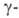 Форма
стабильна при комнатной т-ре, обладает пьезоэлектрич., электрооптич. и
акустооптич. св-вами. При охлаждении нагретой на воздухе
Форма
стабильна при комнатной т-ре, обладает пьезоэлектрич., электрооптич. и
акустооптич. св-вами. При охлаждении нагретой на воздухе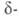 формы
при ~ 646 °С образуется
формы
при ~ 646 °С образуется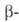 форма,
к-рая при 620-605°С превращ. в
форма,
к-рая при 620-605°С превращ. в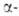 форму.
Увеличение парциального давления О2 повышает т-ру этого перехода
и сужает температурный интервал существования
форму.
Увеличение парциального давления О2 повышает т-ру этого перехода
и сужает температурный интервал существования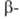 формы;
она особенно устойчива, когда ее состав отвечает ф-ле Bi2O2,7_2,8.
После плавления Bi2O3 в среде О2 и последующего
охлаждения образуется только
формы;
она особенно устойчива, когда ее состав отвечает ф-ле Bi2O2,7_2,8.
После плавления Bi2O3 в среде О2 и последующего
охлаждения образуется только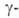 форма.
Влияние примесей нек-рых оксидов (напр., SiO2, GeO2,
B2O3, ZnO) аналогично влиянию избытка кислорода.
форма.
Влияние примесей нек-рых оксидов (напр., SiO2, GeO2,
B2O3, ZnO) аналогично влиянию избытка кислорода.
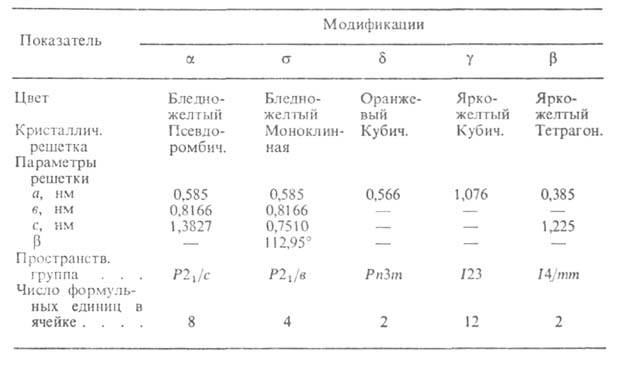
ХАРАКТЕРИСТИКА КРИСТАЛЛИЧЕСКИХ МОДИФИКАЦИЙ Bi2O3
Сесквиоксид не раств. в воде, плохо раств. в р-рах щелочей, с к-тами образует соли Bi(III). При 450-550 °С реагирует с большинством оксидов, гидроксидов и карбонатов металлов с образованием сложных оксидов. Получают взаимод. Bi(NO3)3 с избытком щелочи. Применяют как вяжущее и антисептич. лек. ср-во, флюс в произ-ве эмалей, керамики, фарфора, хрусталя, спец. стекол. Его используют для получения оксидов типа силленита, напр. силикосилленита Bi12SiO20 (служат материалами элементов линий ультразвуковой задержки, модуляторов света и др. в акустооптике и электрооптике) и эвлитина, напр. Bi4Si3O12 (материалы чувствительных элементов сцинтилляционных счетчиков). В природе - минерал бисмит.
Монооксид ВiO - черное твердое в-во; т. пл. ~902°С, т. кип. ~1647°С; плотн. 7,15-7,20 г/см3; образуется при окислении кислородом Na3Bi в жидком NH3. Диоксид ВiO2 - коричневые кристаллы; плотн. 5,6 г/см3; получают окислением Bi(OH)3 в водном аммиаке. Пентаоксид дивисмута Bi2O5 - коричневые или темно-красные кристаллы; плотн. 5,10 г/см3; взаимод. с соляной к-той с выделением С12, с щелочами образует висмутаты, с водой не реагирует; сильный окислитель; образуется при окислении хлором суспензии Bi2O3 в водном р-ре КОН при нагр. до ~100°С.
Известны также гемиоксид Bi2O и оксиды Bi6O7, Bi8O11.
Лит.см. при ст. Висмут. А.А.Майер.

