Радий
РАДИЙ (от лат. radius-луч;
лат. Radium) Ra, радиоактивный хим. элемент II гр. периодич. системы, ат. н.
88; относится к щелочноземельным элементам. Известны изотопы с маc. ч.
206-230. Наиб. долгоживуший-226Rа (T1/2
~ 1600 лет, a-излучатель), ат. м. к-рого 226,0254; входит в состав прир.
радиоактивного ряда 238U. Кроме того, в природе как члены радиоактивных
рядов 232Th и 235U встречаются также 223Ra
(историч. название актиний-икс, символ АсХ, T1/2 11,43 сут),
224Ra (торий-икс, ThX, T1/2 3,66 сут), 228Ra
(мезоторий-1, MsTh1, T1/2 5,75 года). Конфигурация
внеш. электронной оболочки атома 7s2; степень окисления
+2; энергии ионизации Ra0 : Ra+ : Ra2+
: :Ra3+ равны соотв. 5,2790, 10,1472 и 34,3 эВ; электроотрицательность
по Полингу 0,97; металлич. атомный радиус 0,235 нм, ионный радиус Ra2+
0,162 нм (координац. число 8) и 0,184 нм (12).
Р.-чрезвычайно редкий _и
рассеянный элемент. Содержание Р. в земной коре 1·10-10% по массе,
в горных породах 2·10-11-5·10-12 г/г, в донных осадках
5·10-11 г/г. В урановых рудах, являющихся главным его источником,
на 1 т урана приходится не более 0,34 г Р.; в очень малых концентрациях он обнаружен
в самых разных объектах, в частности в прир. водах разл. источников.
В своб. виде Р.-серебристо-белый
блестящий металл, быстро тускнеющий на воздухе; кристаллич. решетка кубич. объемноцентрированная,
а = 0,5148 нм; т. пл. 969 °С (64,82 Па), т. кип. 1507°С; плотн.
5,5-6,0 г/см3; при давлении 64,82 Па и т-ре 969 °С: DHпл
8 кДж/моль, DHвозг 157,9 кДж/моль, DHисп
149,6 кДж/моль; 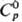 29,3 ДжДмоль·К);
29,3 ДжДмоль·К); 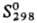 69,1 ДжДмоль·К). Ядра 226Ra излучают a-частицы с энергией 4,777
МэВ; испускание a-частиц сопровождается g-излучением с энергией 0,188
МэВ. В результате самопоглощения a- и b-частиц, испускаемых при радиоактивном
распаде 226Ra и его дочерних продуктов, 1 г 226Ra выделяет
ок. 550 Дж/ч тепла. Продукт распада Р.-радон (ок. 1 мм3 Rn из 1 г
226Ra в сут).
69,1 ДжДмоль·К). Ядра 226Ra излучают a-частицы с энергией 4,777
МэВ; испускание a-частиц сопровождается g-излучением с энергией 0,188
МэВ. В результате самопоглощения a- и b-частиц, испускаемых при радиоактивном
распаде 226Ra и его дочерних продуктов, 1 г 226Ra выделяет
ок. 550 Дж/ч тепла. Продукт распада Р.-радон (ок. 1 мм3 Rn из 1 г
226Ra в сут).
По хим. св-вам Р. похож
на Ва. Практически все соединения Р. изоморфны соответствующим соед. Ва. На
воздухе металлический Р. быстро покрывается темной пленкой, представляющей собой
смесь нитрида и оксида Р. Металлический Р. бурно реагирует с водой с образованием
р-римого в воде гидроксида Ra(OH)2 и выделением Н2. Электродный
потенциал выделения Р. из водных р-ров —1,718В (по отношению к нормальному каломельному
электроду).
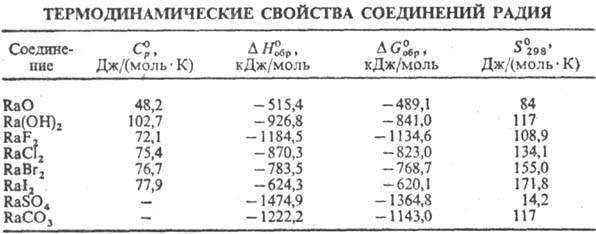
Соединения Р. обладают
св-вом автолюминесценции-свечения в темноте благодаря собств. излучению. Мн.
соли Р. бесцв., но при разложении под действ. собств. излучения приобретают
желтую или коричневую окраску. Хорошо раств. в воде RaCl2 (т. пл.
900 °С, плотн. 4,91 г/см3; см. также табл.), RaBr2
(т. пл. 728 °С, плотн. 5,79 г/см3), RaI2 и Ra(NO3)2.
Лучше других раств. в воде RaBr2 (70 г в 100 г при 20 °С). Хлорид
и бромид Р. кристаллизуются из воды в виде кристаллогидратов с двумя или шестью
молекулами Н2О. Малорастворимые соед.-сульфат RaSO4 (ок.
2·10-4 г в 100 г воды при 20°С), иодат Ra(IO3)2,
фторид RaF2, хромат RaCrO4, карбонат RaCO3
и оксалат RaC2O4. Известны комплексы Р. с лимонной, винной,
яблочной, молочной, этилендиаминтетрауксусной к-тами и др. лигандами. По сравнению
с др. щел.-зем. металлами Р. обладает более слабой склонностью к комплексообразованию.
Выделяют Р. в виде RaCl2
или др. солей как побочный продукт переработки урановых руд (после извлечения
из них U), используя методы осаждения, дробной кристаллизации, ионного обмена;
металлич. Р. получают электролизом р-ра RaCl2
на ртутном катоде, восстановлением RaO алюминием при нагр. в вакууме.
Определяют Р. радиометрич.
методами.
Изучение Р. сыграло огромную
роль в развитии научного познания, т. к. позволило выяснить мн. вопросы, связанные
с явлением радиоактивности. Длит. время Р. был единств. элементом, радиоактивные
св-ва к-рого находили практич. применение в медицине, для приготовления люминофоров
постоянного свечения и др. Добыча Р. в 30-е гг. достигала более 350 г в год.
Однако в 50-е гг. Р. почти повсеместно был вытеснен другими, более дешевыми
искусственно получаемыми радионуклидами. Р. сохранил нек-рое значение в медицине
как источник Rn для приготовления радоновых ванн. В небольших кол-вах Р. в смеси
с Be используют в ампульных источниках нейтронов.
В геологии 228Ra
и др. изотопы применяют для определения возраста океанич. осадочных пород и
минералов, в геохимии 226Ra и 228Ra используют как индикаторы
смешения и циркуляции вод океанов.
Р. сильно токсичен. Допустимая
концентрация в воздухе рабочей зоны (категория A) 223Ra 4,1·10-3,
224Ra 1,2·10-2, 226Ra 9,2·10-4 и
228Ra 6,2·10-4 Бк/л, в атмосферном воздухе (категория
Б) соотв. 1,4·10-4, 4·10-4, 3,1·10-5 и 2,1·10-5
Бк/л, в воде (Б) соотв. 13,44, 1,99 и 3,26 Бк/л.
Об открытии Р. сообщили
в 1898 П. Кюри и М. Склодов-ская-Кюри совместно с Г. Бемоном. Переработав ок.
1 т заводских отходов, оставшихся после извлечения из руды урана, супруги Кюри
выделили 90 мг чистого RaCl2. В СССР первые препараты Р. получены
в 1921 В. Г. Хлопи-ным и И. Я. Башиловым.
Лит.: Вдовенко В.
М., Дубасов Ю. В., Аналитическая химия радия, Л., 1973; Погодин С.А., Либман
Э. П., Как добыли советский радий, 2 изд., М., 1977. С. С. Бердоносов.

