Металлокомплексный катализ
МЕТАЛЛОКOМПЛЕКСНЫЙ КАТАЛИЗ,
основан на взаимод. субстрата с реагентом в координац. сфере комплекса металла.
В ряде случаев аналогичен механизму действия ферментов, содержащих атом металла
в качестве кофактора. М.к. может осуществляться под действием гомогенных и гетерогенных
металлокомплексных катализаторов. Первые присутствуют в р-ре вместе с реагентами
и продуктами р-ции, вторые осуществляют катализ на пов-сти, если они нерастворимы
в данной среде или разл. способами нанесены на носитель (полимер или неорг.
материал). Такие гетеро-генизир. катализаторы М.к. обладают высокой селективностью,
отличаются однородностью активных центров и легкостью их модифицирования, а
также термостабильностью, длительным сроком службы и регенерируемостью. Выделяют
след. особенности комплексов переходных металлов, определяющих их каталитич.
активность. 1) Способность образовывать комплексы с молекулами разл. типов,
к-рые, входя в координац. сферу металла-комплексо-образователя, активируются,
что обеспечивает легкость их дальнейшего взаимодействия. Известны, напр., комплексы
с олефинами (ф-ла I), ацетиленами (II и III), оксидом углерода (IV и V), кислородом
(VI и VII), азотом (VIII и IX) и др. (М-атом металла с лигандами).
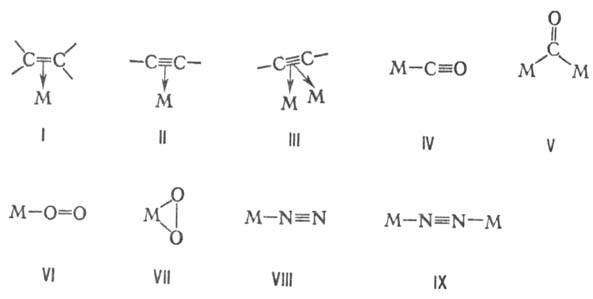
2) Образование комплексов
с координирующим ионом или атомом металла понижает энергию связи реагирующих
молекул субстратов, что уменьшает энергии активации их послед. р-ций по сравнению
с некоординир. молекулами. Понижение энергии связи при комплексообразовании
происходит вследствие частичного переноса электронов со связывающих орбиталей
молекул субстратов на своб. орбитали металлов и обратного переноса электрона
с заполненных d-орбиталей металла на разрыхляющие (антисвязывающие) орбитали
молекул субстратов.
3) В координац. сфере металла
молекулы изменяют свои кислотные или основные св-ва и возникает возможность
кислотно-основного взаимод. при тех значениях рН, при к-рых своб. молекула не
реагирует. Напр., азот в своб. состоянии является исключительно слабым основанием,
а в комплексе типа (R3P)4W(N2)2
становится по основности близким к простым эфирам.
4) Если имеется запрет
по симметрии мол. орбиталей, препятствующий взаимод. молекул, то при р-ции в
координац. сфере металла он может сниматься или значительно ослабляться. Во
внутр. сфере процессы, протекающие через переходное состояние, м. б. разрешены
и могут протекать с малыми энергиями активации, напр.:
а) окислит. присоединение
и обратное ему восстановит. элиминирование молекулы XY:
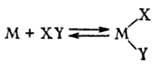
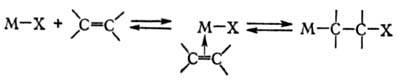
б) внедрение ненасыщенных
соед. по связи М—X и обратное ему b-элиминирование:
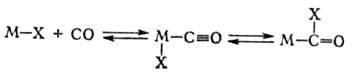
в) обратимое образование
металлоцикла из ненасыщенных соед. и карбена в координац. сфере металла:
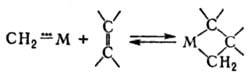
5) М. к. позволяет осуществить
р-ции многоэлектронного окисления и восстановления, в к-рых молекула субстрата
в координац. сфере сразу принимает или отдает неск. электронов. При этом облегчаются
процессы, в к-рых последоват. перенос электронов затруднен из-за термодинамич.
трудностей одно- или двухэлектронных стадий. Особенно благоприятны условия для
таких р-ций в случае многоядерных комплексов-кластеров, способных как к одноэлектронному
окислению (восстановлению) при взаимод. с реагентом, так и послед, n-электронному
окислению (восстановлению) субстрата.
Основные типы реакций,
катализируемых комплексами металлов. Гидрирование. Помимо традиц. металлич.
катализаторов гидрирования в настоящее время применяют мн. металлокомплексы
на основе платиновых металлов. Так, для гидрирования олефинов наиб. часто используют
RhCl(PPh3)3 (кат. Уилкинсона), RuHCl(PPh3)3
и RuCl2(PPh3)3. Катализаторы молекулярного
и ионного типов на основе комплексов Rh, такие, как HRh(CO)(PPh3)3,
Rh2(OCOCH3)4, [Rh(С7Н8)(РРh3+)2]+,
{Rh[PPh(CH3)2]3(C7H8}+,
[Rh(C7H8)Ph2PCH2CH2PPh2]+
, используют для гидрирования олефинов, ацетиленов, кетонов. Иридиевые и платиновые
комплексы в этой р-ции несколько менее активны; среди них наиб. часто применяют
комплексы IrCl(CO)(PPh3)2 и [Pt(SnCl3)5]3-.
Катализаторами гидрирования являются также комплексы неплатиновых металлов,
образующиеся, напр., при действии сильных восстановителей, таких, как Аl(С2Н5)3
и др., на соед. Со, Ti и Zr (т. наз. катализаторы Циглера - Натты), а также
гидриды металлоценов, напр. (h-C5H5)2MH, где
М = Lu, Ti, Mb.
Синтезы с участием оксида
углерода. Для присоединения СО и Н2 к олефинам с образованием альдегидов
(гидроформилирование олефинов) в пром. масштабе применяют октакарбонил Со, к-рый
в условиях катализа пре-вращ. в гидридотетракарбонильный комплекс (см. Гидроформилирование):
Со2(СО)8 + Н2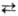 2[НСо(СО)4].
Все большее применение в этой р-ции находят фосфиновые и фосфит-ные комплексы
Rh, напр. HRh(CO)(PPh3)3. В зависимости от реагентов и
условий р-ции синтезы на основе СО могут приводить к образованию альдегидов,
кетонов, высших спиртов, карбоновых к-т и их эфиров. Так, гидрокарбо-нилирование
осуществляется в присутствии Ni(CO)4, напр.: RCH=CH2 +
СО + Н2О
2[НСо(СО)4].
Все большее применение в этой р-ции находят фосфиновые и фосфит-ные комплексы
Rh, напр. HRh(CO)(PPh3)3. В зависимости от реагентов и
условий р-ции синтезы на основе СО могут приводить к образованию альдегидов,
кетонов, высших спиртов, карбоновых к-т и их эфиров. Так, гидрокарбо-нилирование
осуществляется в присутствии Ni(CO)4, напр.: RCH=CH2 +
СО + Н2О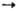 RCH2CH2COOH
+ + RCH(COOH)CH3. Карбонилирование спиртов катализируется соед. Rh,
напр. уксусную к-ту получают из СН3ОН и СО в присут. RhCl3.3H2O
(сокатализатор HI).
RCH2CH2COOH
+ + RCH(COOH)CH3. Карбонилирование спиртов катализируется соед. Rh,
напр. уксусную к-ту получают из СН3ОН и СО в присут. RhCl3.3H2O
(сокатализатор HI).
П о л и м е р и з а ц и
я, д и м е р и з а ц и я, о л и г о м е р
и з а ц и я о л е ф и н о в и ацетиленов. Для этих р-ций наиб.
часто используют катализаторы, образующиеся при взаимод.
алкильных производных Al, Li, Mo, Sn и др. с соед. переходных
металлов (см. Циглера-Натты катализаторы).
Так, при взаимод. Аl(С2Н5)3
с TiCl4 и TiCl3 в углеводородных р-рителях образуются
гетерог. катализаторы полимеризации этилена и a-олефинов; при взаимод. АlСl(С2Н5)2
с (h-C5H5)2TiCl2-гомогенные. Полимеризация
пропилена и др. a-олефинов на таких катализаторах происходит с образованием
стереорегулярных полимеров. Комплексы, образующиеся при взаимод. Аl(С2Н5)3
с Ti(OC4H9)4, катализируют димеризацию этилена.
Для димеризации и олигомеризации олефинов применяют также комплексы Ni, образующиеся
при взаимод. NiCl2, Ni[P(OPh)3]4 с галогени-дами
и алкилгалогенидами Аl.
Бинарные системы СоСl2-АlСl(С2Н5)2,
VСl3(ТГФ)3-АlСl(С2Н5)2
используют для получения стереорегулярных бутадиеновых каучуков. В присут. первого
комплекса образуется полимер, содержащий 93-98% звеньев структуры 1,4-цис,
второго-содержащий до 99% 1,4-транс.
Олигомеризация ацетиленов
в циклооктатетраен или производные бензола протекает в присут. комплексов Ni,
Со, Pd, Rh, Ir, таких, как Ni(CO)4, Co(CO)2(h-C5H5)2,
PdCl2(PhCN)2, RhCl(PPh3)3, IrCl(CO)(PPh3)2.
При контакте газообразного ацетилена с поверхностью р-ра гомог. катализатора,
приготовленного смешением Аl(С2Н5)3 и Ti(OC4H9)4
или фосфиновых комплексов Ni и Со с NaBH4, получается кристаллич.
циc-полиацетилен (поливинилен).
О к и с л е н и е у г л
е в о д о р о д о в в к а р б о н и л ь н
ы е с о е д и н е н и я и э п о к с и д ы. Окисление этилена
в ацетальдегид кислородом воздуха в водном р-ре НСl
(т. наз. Вакер-процесс) катализируется комплексами Pd (сокатализатор
- соль Сu). Окисление этилена на аналогичном
катализаторе в присут. СН3СООН приводит к винилацетату.
Синтез пропиленоксида из пропилена осуществляют
с использованием гексакарбонила молибдена Мо(СО)6
или ацетилацетоната ванадила VO(C5H7O2)2.
Эпоксидирование олефинов
действием Н2О2 или орг. пероксидов катализируется
комплексами Мо, а также пероксимолибденовыми
и пероксиволъфрамовыми соединениями. Радикально-цепное
окисление углеводородов кислородом осуществляется в
присут. солей переходных металлов, таких, как Со(П), Мn(II) и
др. Таким образом проводят синтез терафталевой к-ты из n-ксилола,
уксусной к-ты из бутана и т.п. Все эти процессы находят
широкое применение в пром-сти (см. также Катализаторы
окисления).
М е т а т е з и с о л е
ф и н о в и а ц е т и л е н о в. Р-ции типа СН2=СН2 +
PhCH=CHPh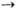 2PhCH=CH2
катализируются комплексами переходных металлов VI и VII групп. Катализаторы
- продукты взаимод. WCl6, МоСl5, W(CO)6, ReCl5
и др. с алкильными производными металлов-AlR3, LiR, SnR4,
RMgX и др.
2PhCH=CH2
катализируются комплексами переходных металлов VI и VII групп. Катализаторы
- продукты взаимод. WCl6, МоСl5, W(CO)6, ReCl5
и др. с алкильными производными металлов-AlR3, LiR, SnR4,
RMgX и др.
Г и д р о с и л и д и р
о в а н и е. Присоединение фрагмента Si—Н к ненасыщенным соед. по р-ции: R3SiH
+ R'R:C=CH2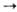 R'R:CHCH2SiR3 протекает в присут. H2PtCl6,
RhCl(PPh3)3, Ni[P(OPh)3]4, Co(C5H7O2)
и др.; находит применение в произ-ве силиконовых полимеров.
R'R:CHCH2SiR3 протекает в присут. H2PtCl6,
RhCl(PPh3)3, Ni[P(OPh)3]4, Co(C5H7O2)
и др.; находит применение в произ-ве силиконовых полимеров.
Фиксация азота. Восстановление
N2 до нитридных производных при комнатной т-ре происходит в присут.
восстановителей (LiR, RMgX, AlR3 и др.) и соед. переходных металлов
(Ti, V, Cr, Mo, W, Fe и др.). В протонных средах в присут. Мо(Ш) или V(II),
напр. V(OH2), N2 образует гидразин и аммиак. В случае
катализаторов на основе Мо(Ш) для протекания р-ции необходимо присутствие в
смеси внеш. восстановителя, в качестве к-рого м. б. использованы Ti(OH)3,
Cr(OH)2 или Na-Hg; при электрохим. восстановлении-ртутный катод.
А к т и в а ц и я а л к
а н о в в р а с т в о р а х. Комплексы Pt при 80-120 °С катализируют изотопный
обмен насыщ. углеводородов с D2O. Эти же комплексы используют при
окислении алканов; так, в водных р-рах в присут. PtCl24
и PtCl2-6 из СН4 образуется СН3Сl
и СН3ОН. Катализаторы Циглера - Натты способствуют гидрометили-рованию
ненасыщенных соед.: в присут. комплекса Ni метан с ацетиленом образуют пропилен.
Комплексы Re, Ir, Ru, Os способствуют дегидрированию алканов до алкенов, сопряженному
с гидрированием акцептора водорода, напр. трет-бутилэтилена. В присут.
фосфинкарбонильных комплексов Rh из алканов и СО образуются альдегиды.
Механизм М.к. В
случае гидрирования типичный механизм элементарной стадии р-ции состоит из окислительного
присоединения Н2 к комплексу (ур-ние 1), комплексо-образования олефина
и внедрения его по связи М—Н (2), восстановительного элиминирования алкана (3):
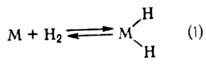
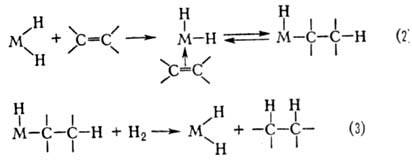
Стадия (2) является ключевой
также в р-циях изомеризации, гидросилилирования и гидроформилирования олефинов.
Полимеризация протекает
по механизму последоват. внедрения молекул олефина по связи М-С:
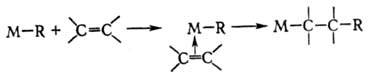
Метатезис обычно протекает
через стадию образования карбеновых комплексов металла с олефинами и обратимое
выделение металлокомплексов (см. Метатезис). При восстановит. фиксации
азота в протонных средах внеш. восстановитель (напр., катод) восстанавливает
соед. Mo(V) или Mo(VI) до Мо(Ш) с образованием кластера, способного координировать
молекулы N2 и переводить их в гидразин путем четырехэлектронного
восстановления.
Развитие М. к., в т. ч.
с использованием принципа действия ферментов, позволяет создавать новые практически
важные каталитич. процессы, протекающие с высокой селективностью по осн. продукту,
высоким выходом, низкими энергозатратами и малым загрязнением окружающей среды.
Лит.: Джеймс Б.,
Гомогенное гидрирование, пер. с англ., М., 1976; Хенрици-Оливэ Г., Оливэ С.,
Координация и катализ, пер. с англ., М., 1980; М., 1981; Мастере К., Гомогенный
катализ переходными металлами, пер. с англ., М., 1983; Накамура А., Цуцуи М.,
Принципы и применение гомогенного катализа, пер. с япон., М., 1983; Хартли Ф.,
Закрепленные металло-комплексы, пер. с англ., М., 1989; "Успехи химии",
1990, т. 59, в. 12; Shilov A. E., Activation of saturated hydrocarbons by transition
metal complexes, Dordrecht, 1984.
A. E. Шилов.

