Алкоголяты
АЛКОГОЛЯТЫ, продукты замещения атома Н в молекуле спирта на металл (М).
Алкоголята одноатомных спиртов. Их общая ф-ла M(OR)n, где n-степень окисления металла. А. щелочных, щел.-зем. металлов, Т1(1) и первичных спиртов-ионные соед.; неплавки, нелетучи; т. разл. 200-300 °С; раств. в спиртах и жидком NH3; электролиты в р-ре. Из спиртовых р-ров обычно выделяются в виде кристаллосольватов. Производные металлов III-VIII групп и спиртов (начиная с С2Н5ОН), а также M1OR-mpem- молекулярные мономерные или олигомерные соед.; имеют низкие т-ры плавления и кипения; хорошо раств. в неполярных р-рителях, плохо-в спиртах; р-ры не проводят ток. Метилаты тех же элементов-обычно координац. полимеры; неплавки, нелетучи; не раств. ни в одном из р-рителей. Большинство А. элементов середины периодич. системы сочетают св-ва ионных и молекулярных соед. (см. табл.). Все А. очень гигроскопичны.
ХАРАКТЕРИСТИКА АЛКОГОЛЯТОВ [М(ОН)n]m
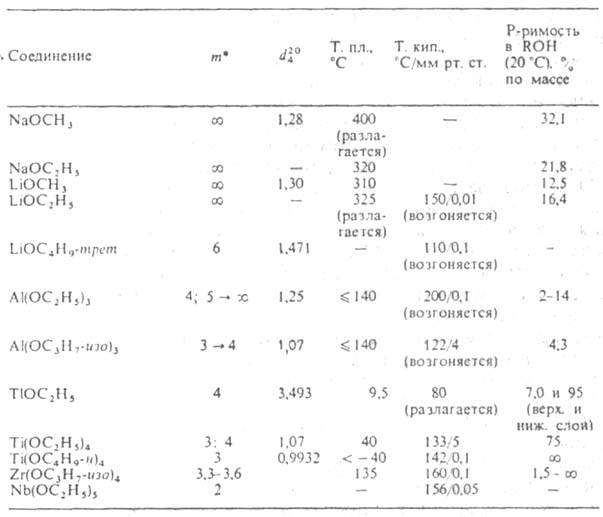
* т-степень ассоциации; стрелкой показано изменение т при старении.
С удлинением R в гомологич. рядах т-ра плавления, плотность, показатель
преломления, р-римость в спирте обычно снижаются, а т-ра кипения (возгонки),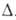 Н
и
Н
и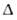 S
испарения,
вязкость увеличиваются. Пространств. затруднения, возрастающие при переходе
от первичных R к вторичным и третичным, препятствуют ассоциации молекул.
В этом же ряду снижаются т-ра кипения (см. рис. 1), вязкость и возрастает
р-римость в неполярных р-рителях. А. ряда многовалентных металлов, напр.
Al, Ga, Ti, Fe(III), образуют неск. ассоциатов разл. состава и строения
(напр., ф-лы VI и IX). Их олигомерные и полимерные молекулы способны к
взаимным превращ., поэтому физ.-хим. св-ва и реакц. способность отдельных
препаратов А. могут изменяться в весьма широких пределах (см. рис. 2).
S
испарения,
вязкость увеличиваются. Пространств. затруднения, возрастающие при переходе
от первичных R к вторичным и третичным, препятствуют ассоциации молекул.
В этом же ряду снижаются т-ра кипения (см. рис. 1), вязкость и возрастает
р-римость в неполярных р-рителях. А. ряда многовалентных металлов, напр.
Al, Ga, Ti, Fe(III), образуют неск. ассоциатов разл. состава и строения
(напр., ф-лы VI и IX). Их олигомерные и полимерные молекулы способны к
взаимным превращ., поэтому физ.-хим. св-ва и реакц. способность отдельных
препаратов А. могут изменяться в весьма широких пределах (см. рис. 2).
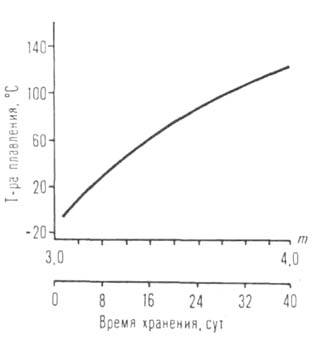
Рис. I. Зависимость т-ры кипения изомерных амилатов Ti, Mb, Al, U
от разветвленности R.
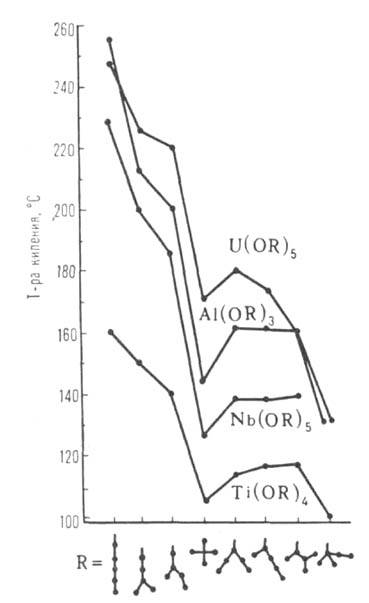
Рис. 2. Зависимость т-ры плавления [А1(ОС3Н7-изо)з]т от степени ассоциации (т) и времени хранения (с момента начала кристаллизации).
Строение ассоциатов определяется принципом "миним. степени полимеризации",
согласно к-рому все атомы М достигают устойчивых координац. чисел (благодаря
донорно-акцепторному взаимод. между своб. орбиталями М и парами электронов
атомов О алкоксильных групп соседних молекул). А. мономерны только в случае
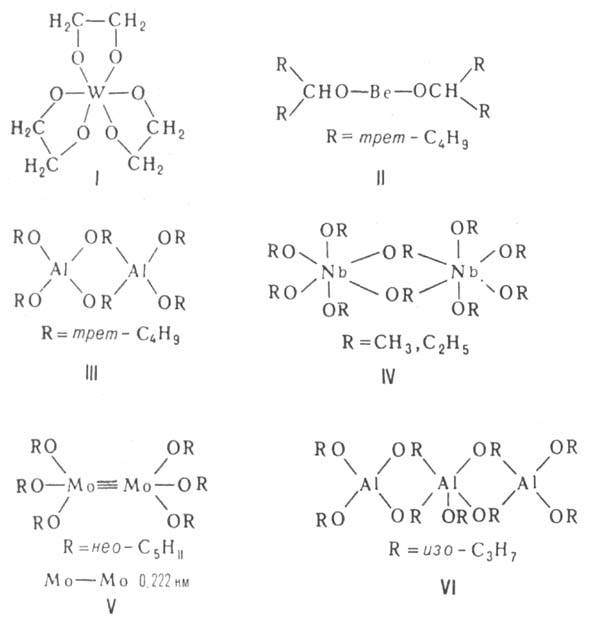
полидентатных или очень разветвленных алкоксилов (см. ф-лы I, II). Ассоциаты
могут иметь разнообразное строение. Димеры способны образовать структуру
из двух многогранников, напр. тетраэдров (III) или октаэдров (IV) с общим
ребром (OR)2, кластеры Мо или W, содержащие кратные связи М—M(V).
Молекулы тримеров представляют собой обычно циклоли-нейные цепочки (VI),
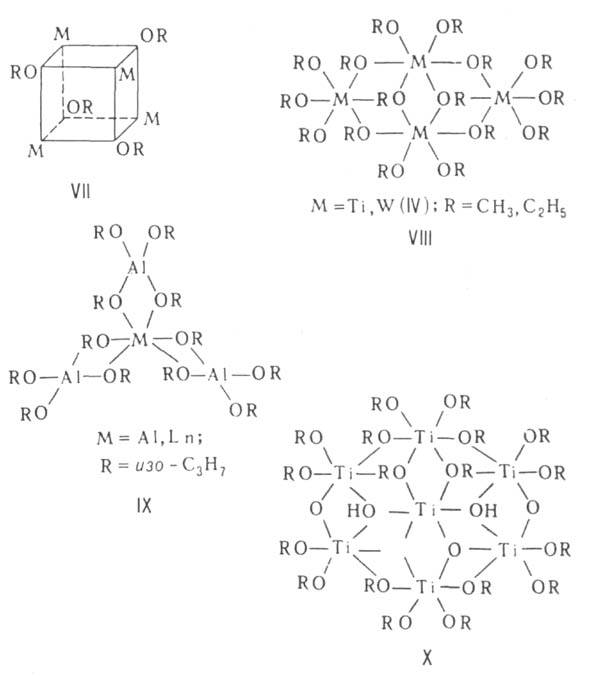
тетрамеров-кубаны (ТЮСН3, КОС4Н9-трет,
CH3ZnOCH3,
VII), плоские молекулы из четырех октаэдров с общими ребрами (VIII) или
молекулы с центральным октаэдром и тремя тетраэдрами по его ребрам (IX).
Метилаты, этилаты и изопропилаты щелочных и щел.-зем. металлов образуют
полимерные кристаллич. структуры из слоев тетраэдров (типа анти-РbО) и
октаэдров [типа Са(ОН)2] соответственно.
Комплексообразование со спиртами, сопровождающееся выделением устойчивых кристаллосольватов [напр., LiOCH3*2CH3OH, т. разл. 28°С; NaOC2H5*2C2H5OH, т. разл. 200°С; Са(ОС2Н5)2*nС2Н5ОН, где п = 4 и 2, т. разл. 60 и 100°С], свойственно гл. обр. А. щелочных и щел.-зем. металлов; в случае многовалентных металлов сольваты со спиртами и др. основаниями Льюиса малоустойчивы, т.к. акцепторная ф-ция М удовлетворяется благодаря образованию прочных OR-мостиков в молекулах ассоциатов. Известны сольваты [М (ОС3Н7-изо)4*L]2, где М = Sn, Zr; L = = изо-С3Н7ОН, ТГФ, пиридин, 2Ti(OR)4*En, 2А1(ОС3Н7-изо)3*Еn [En=(—CH2NH2)2], легко подвергающиеся десольватации. Вместе с тем Al [OCH(CF3)2]3*L [L = (C2H5)2O, (C2H5)3N, (C2H5)3P] перегоняются в вакууме без разложения.
При взаимод. двух разл. А. в р-ре или расплаве образуются биметаллич.
А. (алкоксосоли Меервейна), для к-рых более характерны св-ва молекулярных
соед., чем для компонентов, образующих их. Так, Mg[Al(OC2H5)4]2
в отличие от полимерных этилатов Mg и А1 неограниченно раств. в орг. р-рителях,
перегоняется при 195°С/0,1 мм рт.ст. (т. пл. 181°С), образует димеры, весьма
устойчивые в газовой фазе и р-ре. Комплексообразование А. с галогенидами
металлов приводит к алкоксогалогенидам —М (OR)nHalm.
Ангидриды минер. к-т при взаимод. с А. образуют соли алкилированных к-т:
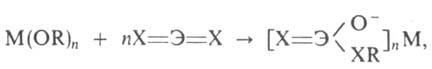
где ЭХ2 = СО2, SO2, CS2;
M = Na, Си. А. типа (изо-RO)3Mo=Mo(OR-изо)3 обратимо
связывает СО, СО2 и необратимо - О2, NO, C2H2;
присоединенные лиганды L (за исключением О2 и NO) становятся
мостиковыми:
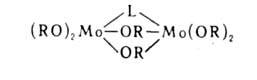
С соед., содержащими активный атом Н, А. вступают в р-цию обмена: М (OR)n + п НХ -> МХn + n ROH, где X = Hal, ОН, OR, SH, NH2 и др. Р-цию широко применяют в синтезе безводных неорг. и орг. производных металлов, т.к. единственный побочный продукт в этом случае-спирт.
При контролируемом гидролизе А. многовалентных металлов следами влаги кристаллизуют продукты, содержащие оксо-мостики (см., напр., ф-лу X). Конечные продукты гидролиза А. - гидроксиды; они отличаются высокой реакц. способностью, образуют устойчивые гидрогели и дегидратируются при весьма низких т-рах с образованием мелкодисперсных оксидов.
В окислит.-восстановит. р-ции, сопровождающиеся изменением степени окисления М, вступают в осн. А. переходных металлов (р-цию используют для получения А. тех же металлов в новых степенях окисления).
А. щелочных или щел.-зем. металлов получают взаимод. металла со спиртом.
Иногда эту р-цию проводят в р-ре углеводорода или жидкого NH3.
Бериллий, Al, Y, Ln реагируют со спиртами в присут. HgCl2, I2,
HHal или галогенидов тех же металлов. Алкоголяты Ge, Ti, Zr, Nb, Та, Y,
Sc и La получают анодным окислением металла в спирте в присут. электропроводной
добавки [R4N] Br. Алкоголяты щелочных, щел.-зем. металлов, T1(I),
V(V), Mo (VI), Re (VII), Os (VIII) получают также алкоголизом их оксидов
или гидроксидов:
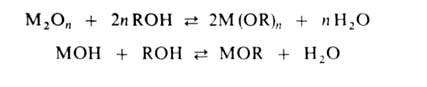
Равновесие смещают вправо связыванием или удалением воды отгонкой. Достаточно
универсален метод синтеза А. алкоголизом ряда соед.:
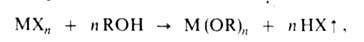
где X = Н, R', NH2, NR2, N[Si(CH3)3]2-
Однако применение этого метода ограничено трудностями синтеза МХn.
А. синтезируют также алкоксилированием хлоридов металлов щелочными А. или
смесью NH3 с ROH, обычно в спиртовом или спирто-бензольном р-ре,
напр.:
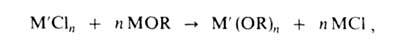
где М = Na, Li, NR4; n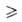 3.
В синтезе р-римых А. используют NaOR (NaCl выпадает в осадок), в синтезе
нерастворимых, напр. мeтилaтoв,-LiOR (LiCl раств. в СН3ОН).
Р-ция протекает через образование биметаллич. А. Модификация метода - взаимод.
легкодоступных пиридиниевых солей хлорометаллатов с NH3:
3.
В синтезе р-римых А. используют NaOR (NaCl выпадает в осадок), в синтезе
нерастворимых, напр. мeтилaтoв,-LiOR (LiCl раств. в СН3ОН).
Р-ция протекает через образование биметаллич. А. Модификация метода - взаимод.
легкодоступных пиридиниевых солей хлорометаллатов с NH3:
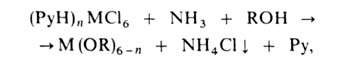
где Ру = пиридин, М = Zr, Ce(IV), Pu(IV), UO3+ , UO22+.
Равновесие "переэтерификации" А. др. спиртом: М (OR)n + п
R'OH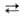 М
(OR')n + п ROH сдвигают вправо отгонкой азеотропа ROH
с бензолом или многократным введением новых порций ROH. В случае близких
т-р кипения обоих спиртов целесообразна замена ROH сложным эфиром:
М
(OR')n + п ROH сдвигают вправо отгонкой азеотропа ROH
с бензолом или многократным введением новых порций ROH. В случае близких
т-р кипения обоих спиртов целесообразна замена ROH сложным эфиром:
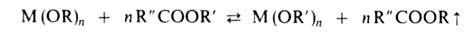
А. ряда переходных металлов м. б. получены окислит.-восстановит. р-циями, напр. окислением Cr(OR-трет)3 кислородом, бромом или Рb(СН3СОО)4 до Cr(OR-трет)4. Окислителями служат сложные эфиры, напр. U(OR)5 превращ. при их действии в U(OR)6. Восстановление (NH4)2CrO4 в спиртовом р-ре под действием УФ-облучения приводит к Cr(OR)3; Ti(OR)4 восстанавливается металлич. К до Ti(OR)3.
А. одноатомных спиртов используют для селективного восстановления группы С=О (см. Меервепна-Понндорфа-Верлея реакция, Оппеиауэра реакция), как катализаторы диспропорционирования альдегидов (см. Тищенко реакция), конденсации, полимеризации и др. Щелочные А.-алкоксилирующие агенты (см. Вильямсона синтез). Алкоголяты А1 и Ti-гидрофобизаторы и сшивающие агенты для эпоксидных и полиэфирных смол, кремнийорг. полимеров. Продукты частичного гидролиза и пиролиза А.-полиорганометаллоксаны-компоненты термостойких покрытий. Из А. в результате их гидролиза, пиролиза или окисления получают высокочистые и активные оксиды металлов.
Алкоголяты гликолей и многоатомных спиртов. Наиб. изучены А. глицерина (глицераты) и А. гликолей (гликоляты).
А. многоатомных спиртов и гликолей -хелаты (мономерные, олигомерные)
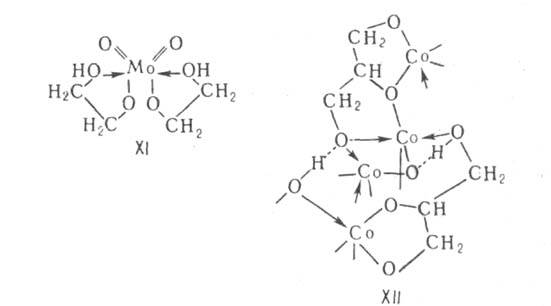
или полимеры, содержащие полидентатные лиганды. Хелаты встречаются чаще
всего среди А. с не полностью замещенными группами ОН в исходном спирте
(напр., ф-ла XI). Такие А. склонны к образованию сольватов с любыми спиртами.
Представляют собой гигроскопичные кристаллы; производные щелочных и щел.-зем.
металлов раств. в спиртах, разлагаются ниже 200°С, производные многова-.
лентных металлов (Со, Ti или др.) раств. также в неполярных р-рителях,
летучи и низкоплавки. Полностью замещенные А.-аморфные полимеры, реже-кристаллические
(напр., глицерат Со ф-лы XII). В отличие от M(OAlk)n они устойчивы
к гидролизу, нерастворимы, неплавки, термостойки.
Однозамещенные А. образуются действием на многоатомные спирты и диолы избытка щелочного, щел.-зем. металла или MOAlk; полностью замещенные А. тех же металлов-диспропорционированием при высоких т-рах:
2NaO(CH2)2OH NaO(CH2)2ONa + НО(СН2)2ОН
NaO(CH2)2ONa + НО(СН2)2ОН
Двухзамещенные гликоляты и трехзамещенные глицераты многовалентных металлов получают взаимод. оксидов, гидроксидов, М (ОА1к)n, оксалатов, ацетатов соотв. с гликолем или глицерином при т-рах выше 250°С.
Особый класс - пирофорные продукты взаимод. СО со щелочными или щел.-зем.
металлами (считавшиеся раньше "солями гексаоксибензола"). Они представляют
собой двухзамещенные производные гипотетич. ацетилендиола НОС СОН.
СОН.
Лит.: Турова Н. Я.. Новоселова А. В., "Успехи химии", 1965. т.
34, в. 3, с. 385-433; Пенкось Р., там же, 1968, т. 37, в. 4, с. 647-76;
Брэдл и Д., там же, 1979, т. 47, в. 4, с. 638-78; Новоселова А.В. [и др.],
"Изв. АН СССР, Сер. неорг. материалы", 1979, т. 15, № 6, с. 1055-67; Шрейдер
В. А. [и др.], "Изв. АН СССР, Сер. хим.", 1981, № 8, с. 1687-92. Н.Я.
Турова.

