Летучесть
m(T, р) = m0(T) + RT lnf( T,р), (1)
где m(T, р) - хим. потенциал в-ва, m0(T) - его стандартный хим. потенциал, равный хим. потенциалу в нек-ром гипотетич. состоянии, в к-ром при данной т-ре и давлении, равном 1 (p = 1 атм), газ обладал бы св-вами идеального газа; R - газовая постоянная. Для i-го компонента газовой смеси.
mi(T,p,N1,...,Nk_1) = mi0(T) + RT lnfi(T,p,N1,...,Nk_1), (2)
где k - число компонентов, N1,..., Nk_1 - молярные доли 1-го,..., (k-1)-го компонентов, fi - летучесть i-го компонента. Если рассматривают два состояния системы с одинаковой т-рой, летучести компонента в этих состояниях fi' и fi: связаны с его хим. потенциалами mi' и mi'' соотношением:
ln (fi:/fi') = (mi''-mi')/RT. (3)
При предельном разрежении газа (p:0) Л. компонента совпадает с его парциальным давлением pi = pNi. где Ni - молярная доля, т.е. lim (fi/pi) = 1. Л. индивидуального (чистого) в-ва при р:0 равна давлению. Л. идеального газа совпадает с давлением. Величину gi=fi/pi наз. коэффициентом летучести (для индивидуального газа g = f/p). По форме (1) и (2) аналогичны выражениям для хим. потенциала чистого идеального газа и компонента смеси идеальных газов соотв.:
mид(T,p) = m0(T) + RT ln p, (4)
mi ид(T, p, Ni) = mi0(T) + RT ln pi, (5)
причем стандартные хим. потенциалы m0(T) и mi0(T) в выражениях (1) и (4), (2) и (5) совпадают. Поэтому ур-ния, являющиеся следствием зависимостей (4) и (5) для идеального газа, можно применить к реальному газу, заменив в них давление р (парциальное давление pi) на Л. В частности, в случае газофазной р-ции 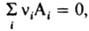 где ni -
стехиометрич. коэффициенты реагирующих в-в Аi, константа хим. равновесия для идеальных газов
где ni -
стехиометрич. коэффициенты реагирующих в-в Аi, константа хим. равновесия для идеальных газов 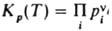 ,
а для реальных газов
,
а для реальных газов 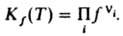 Л. в-ва, являющегося
компонентом конденсир. фазы (жидкой или твердой), совпадает с Л. этого в-ва в равновесной паровой фазе и также подчиняется соотношениям (1)-(3). Условие равенства хим. потенциалов компонента в сосуществующих фазах эквивалентно условию равенства его Л. в этих фазах, что обычно используют при расчетах фазовых равновесий.
Зависимости f(T, p)и g(Т, р)определяются природой в-ва. Величина RT lng представляет собой вклад в значение хим. потенциала в-ва, обусловленный межмол. взаимодействиями. Характер зависимости g(р)при Т = const для данного газа неодинаков в разл. температурных интервалах, определяемых критич. т-рой Ткр. При Т а 4Ткр g монотонно возрастает с ростом р (g > 1, f > p), не отличаясь, однако, сильно от 1; при этом чем выше т-ра, тем значения g(р)ближе к 1. В этой области т-р отклонения поведения газа от идеального определяются в осн. межмол. отталкиванием. При т-рах около Ткр g с ростом р сначала уменьшается (g < 1, f < p), затем начинает возрастать; с понижением т-ры значения g(р)уменьшаются. Для обычных мол. газов (напр., атм. воздуха) при р [ 1 атм (100 кПа) и не слишком низких т-рах отличие Л. от давления незначительно. Исключение составляют ассоциированные газы, напр. пары к-т НСООН, СН3СООН, С2Н5СООН.
Л. определяют экспериментально по данным о зависимости объема V системы от р при постоянной Т или рассчитывают с помощью термич. ур-ния состояния. Для расчета Л. чистого в-ва применяют обычно одно из след. соотношений:
Л. в-ва, являющегося
компонентом конденсир. фазы (жидкой или твердой), совпадает с Л. этого в-ва в равновесной паровой фазе и также подчиняется соотношениям (1)-(3). Условие равенства хим. потенциалов компонента в сосуществующих фазах эквивалентно условию равенства его Л. в этих фазах, что обычно используют при расчетах фазовых равновесий.
Зависимости f(T, p)и g(Т, р)определяются природой в-ва. Величина RT lng представляет собой вклад в значение хим. потенциала в-ва, обусловленный межмол. взаимодействиями. Характер зависимости g(р)при Т = const для данного газа неодинаков в разл. температурных интервалах, определяемых критич. т-рой Ткр. При Т а 4Ткр g монотонно возрастает с ростом р (g > 1, f > p), не отличаясь, однако, сильно от 1; при этом чем выше т-ра, тем значения g(р)ближе к 1. В этой области т-р отклонения поведения газа от идеального определяются в осн. межмол. отталкиванием. При т-рах около Ткр g с ростом р сначала уменьшается (g < 1, f < p), затем начинает возрастать; с понижением т-ры значения g(р)уменьшаются. Для обычных мол. газов (напр., атм. воздуха) при р [ 1 атм (100 кПа) и не слишком низких т-рах отличие Л. от давления незначительно. Исключение составляют ассоциированные газы, напр. пары к-т НСООН, СН3СООН, С2Н5СООН.
Л. определяют экспериментально по данным о зависимости объема V системы от р при постоянной Т или рассчитывают с помощью термич. ур-ния состояния. Для расчета Л. чистого в-ва применяют обычно одно из след. соотношений:
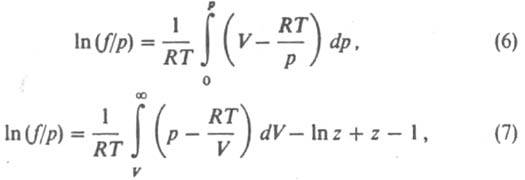
где z = pV/RT. При небольших давлениях ln (f/p)~ B2p/RT, где В2 - второй вириальный коэффициент; для грубых оценок используют соотношение f = р2/рид, где рид = RT/V. Л. жидкости определяют по давлению ее насыщ. пара рнас при заданной т-ре. Для любого р
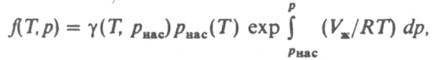
где f(T. p) - Л. жидкости, Vж - ее молярный объем, g (Т, pнaс) - коэф. Л. в-ва в паровой фазе.
Аналогом выражения (6) в случае смеси газов является соотношение:
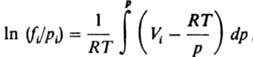
где Vi - парциальный молярный объем i-го компонента смеси. При невысоких давлениях для в-в, не сильно отличающихся по св-вам, приближенно выполняется правило Льюиса: коэф. Л. компонента газовой смеси совпадает с коэф. Л. чистого газа при давлении, равном общему давлению смеси:
gi(T, p, N1,..., Nk_1) ~ gi(T, p, Ni = 1).
Понятие Л. введено Г. Льюисом в 1901. Лит.: Карапетьянц М. Х., Химическая термодинамика, 3 изд., М., 1975; Рид Р. К., Праусниц Дж. М., Шервуд Т., Свойства газов и жидкосгей. пер. с англ., 3 изд;, Л., 1982. Н. А. Смирнова.

