Лазеры химические
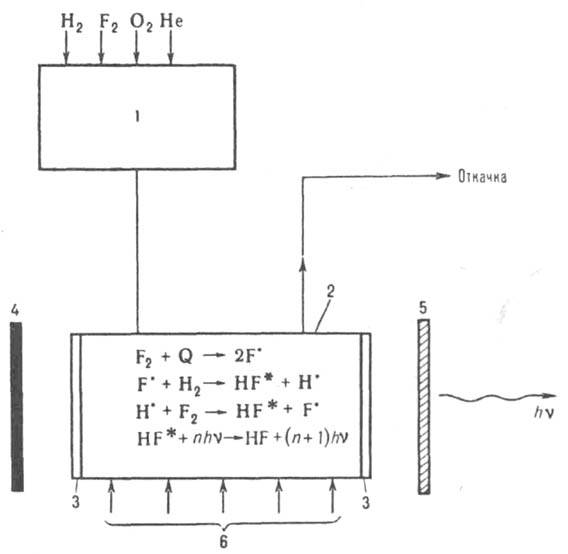
Рис. 1. Схема фтор-водородпого лазера с нехим. инициированием: 1 - смеситель; 2 - активная зона (реактор); 3 - окна для выхода излучения; 4 и 5 - зеркала (непрозрачное и частично отражающее); 6 - инициирующий агент Q (УФ излучение или пучок электронов). Указаны основные процессы в реакторе; полный их набор включает десятки процессов, в т. ч. релаксацию и гибель активных центров.
Из смесителя 1 (рис. 1) рабочая смесь поступает в реактор 2, где под действием УФ облучения или пучка электронов (инициирующий агент) инициируется быстрая молекулярно-радикальная р-ция, высвобождающая запасенную в смеси энергию в виде короткого импульса когерентного излучения. При одной и той же степени инициирования чем больше хемолазерная длина цепи р-ции, тем выше энергия лазерного импульса. наиб. употребительны смеси, содержащие молекулярные фтор и водород (дейтерий), стабилизированные кислородом. Эти смеси обладают наиб. хемолазерной цепью. Генерирующими молекулами в них являются колебательно возбужденные HF* (DF*). На рис. 2 представлена схема Л. х. с чисто химическим способом инициирования, работающего на основе нецепной р-ции атомарного фтора с молекулярным водородом (или дейтерием).
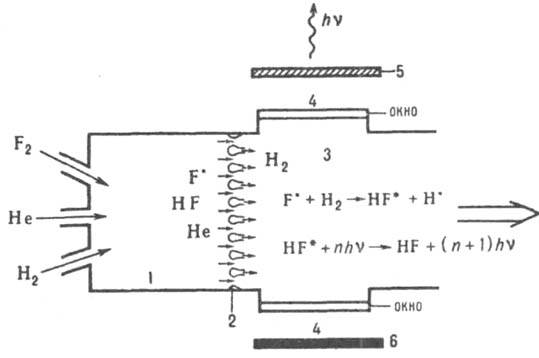
Рис. 2. Схема фтор-водородного лазера с хим. инициированием (термодиссоииацией); 1 - камера сгорания; 2 сопловый блок; 3 активная зона (реактор); 4 - окна для выхода излучения; 5 и 6 - зеркала.
Активные центры - атомы фтора - нарабатываются в камере сгорания в результате тепловой диссоциации избыточного F2, к-рый одновременно служит окислителем горючего. В качестве горючего используют в-ва, осн. требование к к-рым состоит в том, чтобы продукты сгорания не тушили возбужденные молекулы, образующиеся в активной зоне и генерирующие лазерное излучение. Из камеры сгорания 1 атомарный фтор выпускается через сопловую решетку 2, в к-рой он разгоняется до сверхзвуковых скоростей и разбивается на мелкие струи для эффективного смешения с Н2, к-рый подается в активную зону лазера. Р-ция между атомарными фтором и водородом приводит к образованию колебательно возбужденных молекул HF*, к-рые генерируют излучение с длиной волны в диапазоне 2,7-3,2 мкм. Замена водорода дейтерием дает возможность получить когерентное излучение в диапазоне длин волн 3,8 4,2 мкм. Высокая т-ра в камере сгорания (~1800 К) позволяет создать высокоскоростной сверхзвуковой поток реагентов, что увеличивает мощность лазера. Гелий выполняет роль газа-разбавителя, препятствующего катастрофич. повышению т-ры в лазерной зоне, к-рое могло бы привести к срыву генерации и тепловому запиранию сверхзвукового потока. При непрерывной подаче и откачке компонентов такие Л. х. работают в непрерывном режиме. Решающим обстоятельством при их создании является разделение в пространстве процессов наработки химически активных центров и получения возбужденных частиц, генерирующих излучение. Высокотемпературную камеру сгорания можно заменить низкотемпературной, если использовать цепную р-цию фтора с дейтерием. Атомарный фтор для инициирования цепного процесса нарабатывается при низкотемпературной р-ции NO.+F.:F.+NOF, начинающейся сразу при смешении их потоков. Истечение газов из камеры инициирования в лазерную зону происходит с дозвуковой скоростью, хотя возможны и сверхзвуковые варианты этого Л. х. Генерирующая молекула - СО2, к-рая возбуждается путем передачи колебат. энергии от DF*. Возбужденная молекула СО2 релаксирует медленнее, чем DF*, что обеспечивает большую хемолазерную длину цепи. Замена дейтерия на водород приводит к снижению генерируемой мощности, т. к. HF* передает энергию СО2 менее эффективно, чем DF*. По своим мощностным и энергетич. показателям фторводородные Л. х. импульсного и непрерывного действия пока не имеют равных. Среди др. типов Л.х. следует отметить кислород-йодный лазер, в к-ром генерирующая частица - атомарный иод в состоянии 3P1/2. Возбуждается он в это состояние путем передачи энергии от молекул О2 в возбужденном синглетном состоянии 1D, к-рые образуются при р-ции Сl2 с водным р-ром Н2О2 и NaOH. Образование атомарного иода из молекулярного происходит при р-ции:
2O2(1D)+I2:2O2(1S)+2I(3P1/2)
Основные р-ции, приводящие к формированию активной среды и генерации когерентного излучения, следующие:
O2(1D)+I(3P3/2):O2(3S)+I(3P1/2);
I(3P1/2)+nhv:I(3P3/2)+(n +1)hv
Длина волны генерируемого когерентного излучения 1,315 мкм. Среди др. типов Л. х. перспективны лазеры на основе разветвленной цепной р-ции горения CS2; генерирующая молекула-колебательно-возбужденный СО* (длина волны лазерного излучения ~5 мкм); ОН-СО2 - Л.х. на основе р-ции Н+О3:ОН*+О2. Колебательно-возбужденный радикал ОН* передает энергию молекуле СО2, к-рая генерирует лазерное излучение с длиной волны ~10 мкм. Можно ожидать создания Л. х., излучающего в видимом диапазоне длин волн. Л. х. широко применяют в научных экспериментах в хим. кинетике, лазерной химии и спектроскопии. Это обусловлено прежде всего тем, что в диапазоне длин волн, равных 3-4 мкм, нет других достаточно интенсивных источников когерентного излучения. Техн. применения Л.х. находятся в процессе разработки. Рассматриваются проекты использования мощных фтор-водородных и кислород-йодных Л.х. для управляемого термоядерного синтеза. Кислород-йодный Л.х., генерирующий излучение в ближнем ИК диапазоне, представляет интерес для обработки материалов. Спектр излучения фтор-водородных и кислород-йодных Л. х. перекрывает диапазон поглощения огромного числа разл. молекул. Возможность генерации большого набора частот в одном лазерном импульсе делает эти Л. х. перспективными для создания систем диагностики и контроля состава газовых смесей, в т. ч. дистанционных локаторов состава и состояния атмосферы - лидаров . Не исключено, что Л. х., обладая большой энергией излучения на единицу массы расходуемых реагентов, окажутся полезными при развитии технологии в космосе (напр., лазерной сварки). В иностранной литературе обсуждаются военные применения Л. х. Лит.: Химические лазеры, под ред. Р. Гросса и Дж. Ботта, пер. с англ.. М., 1980; Химические лазеры, под ред. Н. Г. Басова, М., 1982; Басов Н. Г., Ораевский А.Н., Химические лазеры, в кн.: Наука и человечество, М., 1983, с. 259 73. А.Н. Ораевский.

