5-пиразолон
5-ПИРАЗОЛОН,
мол. м. 84,08; бесцв. кристаллы; т. пл. 1650C; раств. в воде и этаноле,
плохо-в диэтиловом эфире, толуоле, хлороформе и бензоле. Теоретически может
находиться в восьми таутомерных формах, но практически обнаружены только четыре
(в ф-лах I-IV R = H):
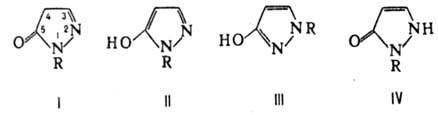
Таутомер III более устойчив,
чем II. В неполярных р-рите-лях преобладают таутомеры I и III, в полярных апротонных
р-рителях - таутомер III, а в протонных р-рителях-Ш и IV. N-Замещенные П. (в
ф-лах I-IV R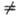 H)
в газовой фазе находятся преим. в форме I, в полярных апротонных р-рителях-в
формах II и III, а в протонных р-рителях-в форме IV.
H)
в газовой фазе находятся преим. в форме I, в полярных апротонных р-рителях-в
формах II и III, а в протонных р-рителях-в форме IV.
П. конденсируется с альдегидами
и кетонами, при взаи-мод. с нитрозосоединениями образует азометиновые соед.,
вступает в р-ции азосочетания; нитруется, сульфируется и галогенируется в положение
4. Получают П. взаимод. этилового эфира b-оксопропионовой к-ты с гидразином.
На основе П. синтезированы
азометиновые красители и мн. лек. ср-ва, напр. антипирин и амидопирин
- производные таутомера IV (см. Анальгетические средства).
Получено большое число
производных П. Наиб. широко распространен и хорошо изучен 1-фенил-3-метил-5-пиразо-лон
(ФМП; V), на примере к-рого ниже рассматриваются св-ва производных П. ФМП-амфотерное
соед., в р-ре ведет себя как слабая к-та и слабое основание. При взаимод. с
HNO2 образует 4-гидроксиминопроизводное. При нитровании и сульфировании
замещение начинается с пара-положения фенильного цикла, в более жестких
условиях идет замещение по положению 4 пиразолонового кольца; так получают,
напр., пикролоновую к-ту (VI) - производное таутомера II.
 ·
·
ФМП восстанавливается только
в очень жестких условиях напр. при перегонке над Zn или красным фосфором. При
до йствии даже слабых окислителей типа FeCl3 образуется соединение
VIII, при действии P2S5 (в ксилоле) -тиопиразол VII, по
св-вам аналогичный меркаптанам. Алки-лирование ФМП может приводить к разл. продуктам;
в частности, при метилировании CH3I в запаянных трубках образуется
антипирин, а при взаимод. с диазометаном 1-фенил-3-метил-5-метоксипиразол.
Благодаря наличию активной
метиленовой группы в положении 4, ФМП вступает в р-ции с нитрозаминами (с образованием
азометиновых красителей), со многими карбонильными соед., солями диазония.
С альдегидами и кетонами
ФМП может образовывать в зависимости от условий два типа соед. (IX и X):
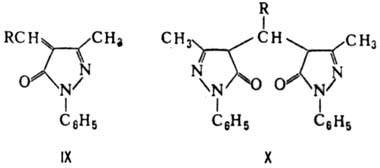
ФМП и продукты его конденсации
с альдегидами вступают в р-ции комплексообразования с рядом элементов и используются
как аналит. реагенты для выделения и разделения Pt, Ag, Cu, Zn и др.
При сочетании ФМП с диазосоединениями
получаются светопрочные красители, многие из к-рых нашли применение в цветной
фотографии. При конденсации ароматич. кетонов с ФМП (или с антипирином) в присут
POCl3 образуются т. наз. антипириновые красители, в частности хромпиразолы.
С неорг. ионами они образуют ярко окрашенные комплексные соед., что используется
для фото-метрич. определения большой группы элементов (Si, P, Ge, Zn, Cd и др.).
При ацилировании получаются как О-, так и С-ацилзамещенные П. 4-Ацилпиразолоны
(напр., 1-фенил-3-метил-4-бензоилпиразолон) широко используются в аналит. химии
как экстрагенты.
Антипирин с альдегидами
образует производные ди-антипирилметана, к-рые широко используются в
качестве аналит. реагентов и ингибиторов коррозии.
Лит. Золотов Ю.
А., Кузьмин H M., Экстракция металлов ацилпиразолонами, M., 1977; Петров Б.
И., Mосквитинова T. Б., "Ж аналит химии", 1982, т 37, № 7, с. 1185
92; Общая органическая химия, т 8, Азотсодержащие гетероциклы, M., 1985; Kusybala
Z., Gасa J., "J. prakt. Chem.", 1988, Bd 330, H. 3. р. 435 В
П Живописцев

