Электрохимический импеданс
ЭЛЕКТРОХИМИЧЕСКИЙ ИМПЕДАНС,
сопротивление
электрохим. системы протекающему через нее переменному току. Если к системе
приложено переменное напряжение, изменяющееся по гармонич. закону и имеющее
малую амплитуду, то через систему идет ток синусоидальной формы, как правило,
опережающий питающее напряжение по фазе. Электрич. импеданс системы Z представляет
собой коэф. в алгебраич. ур-нии, связывающем ток и питающее напряжение;
эта величина выражается комплексным числом.
Наиб. часто Э. и. системы моделируется
пассивной электрич. цепью в виде последовательно соединенных сопротивления
Rs и емкости Cs. Активное сопротивление
отражает влияние электрич. сопротивления электролита, замедленность переноса
заряда через границу электрод-р-р, замедленность диффузии электрохимически
активных в-в. Емкостное сопротивление отражает емкость двойного электрич.
слоя, диффузию присутствующих в р-ре ПАВ, их адсорбцию (десорбцию) на электроде.
При этом
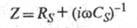
(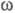 -
частота питающего напряжения; i - мнимая единица). Импеданс Z как
ф-ция iw
является дифференцируемой величиной (это означает, что сопротивление электрохим.
цепи Rs и ее емкость Cs связаны между
собой интегральными соотношениями Крамерса-Кронига).
-
частота питающего напряжения; i - мнимая единица). Импеданс Z как
ф-ция iw
является дифференцируемой величиной (это означает, что сопротивление электрохим.
цепи Rs и ее емкость Cs связаны между
собой интегральными соотношениями Крамерса-Кронига).
Представление об импедансе как о коэф.
связи между двумя величинами, гармонически изменяющимися во времени с частотой
со, повсеместно принято в науке и технике. Одну из изменяющихся величин
условно наз. входной величиной или возмущением, другую - выходной величиной
или откликом. В рамках термодинамики необратимых процессов
входные
величины отождествляют, как правило, с обобщенными термодинамич. силами,
выходные - с термодинамич. потоками и используют соотношения взаимности
Онсагера. В электрохим. системах роль обобщенной силы играет потенциал
электрода, роль потока - электрич. ток (т. наз. фарадеевский импеданс).
Существуют и другие Э. и.: фотоэлектрохимический (входная величина - световой
поток, выходная - электрич. ток), метод электроотражения (входная величина
- потенциал электрода, выходная - модуляция светового потока), лазерного
импульса (входная величина - теплота, выходная - кол-во электричества или
потенциал электрода) и др. Многочисленные релаксационные методы объединяют
термином "импедансная электрохим. спектроскопия".
Фарадеевский импеданс.
Измерения
Э. и. и его зависимость от частоты переменного тока позволяют исследовать
разл. св-ва электрохим. ячейки. Один из способов состоит в том, что процесс
в ячейке моделируют эквивалентными электрич. схемами. Напр., протекающий
на электродах окислит.-восстановит. процесс в отсутствие заметной адсорбции
электрохимически активных в-в моделируется т. наз. схемой Рэндлса-Эршлера
(рис. я). Чисто активное сопротивление Rctописывает замедленность
собственно электрохим. стадии (сопротивление переноса заряда). Если п
-число участвующих в электродном процессе электронов, iоб
-ток обмена (см. Ток обмена), а площадь электрода равна единице,
то Rct = RT/nFio6 (Т - абс. т-ра; R -
газовая постоянная; F - число Фарадея). Емкость двойного электрич.
слоя моделируется шунтирующей емкостью CDL,
не зависящей
от частоты тока (до частот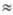 106
Гц). Диффузия реагирующих частиц к электроду и отвод продуктов р-ции от
электрода в р-р моделируют т. наз. диффузионным импедансом, или импедансом
Варбурга W - электрич. цепью со сдвигом фаз между током и напряжением
в 45°. Если с0 - концентрация электрохимически активного
в-ва в р-ре, D - коэф. диффузии, а площадь электрода равна единице,
то
106
Гц). Диффузия реагирующих частиц к электроду и отвод продуктов р-ции от
электрода в р-р моделируют т. наз. диффузионным импедансом, или импедансом
Варбурга W - электрич. цепью со сдвигом фаз между током и напряжением
в 45°. Если с0 - концентрация электрохимически активного
в-ва в р-ре, D - коэф. диффузии, а площадь электрода равна единице,
то
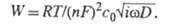
В условиях присутствия в электролите ПАВ процесс в ячейке моделируется схемой Фрумкина-Мелик-Гайказяна (рис., б). Адсорбционная емкость Са дополняет высокочастотную емкость электродного процесса СHF, активное сопротивление Ra описывает замедленность собственно адсорбц. процесса, импеданс Варбурга Wa отвечает диффузии ПАВ к электроду.
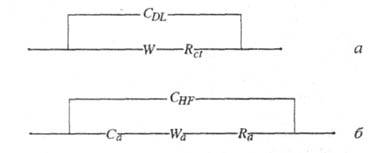
Эквивалентные электрические схемы Рэндлса-Эршлера (а) и Фрумкина-Мелик-Гайказяна (б): CDL - емкость двойного электрич. слоя; W и Wa - импедансы Варбурга; Rct и Ra - чисто активные сопротивления; CHF - высокочастотная емкость электрода; Са - адсорбционная емкость.
Если электродный процесс осложнен предшествующей
или последующей хим. р-цией в приэлектродных слоях электролита, в эквивалентных
схемах появляется т. наз. импеданс Геришера. Нелинейные св-ва электрохим.
системы, вызывающие появление сигналов второго порядка малости, учитываются
в фарадеевского выпрямления методе.
Практич. измерения Э. и. осуществляют
с помощью мостов переменного тока или приборов с фазочувствит. системой
(см. Импедансный метод). Появление эксперим. техники на основе корреляционных
способов обработки сигнала сделало метод Э. и. одним из наиб. точных, а
широкая область возможных для применения частот (от 10-3 до
105 Гц) придала ему необычайную гибкость.
Э. и. широко используют для изучения фундам.
проблем электрохим. кинетики и термодинамики, для исследования процессов
в химических источниках тока (в т. ч. в топливных элементах), расплавах,
твердых электролитах, электрохим. сенсорах, электрохим. преобразователях
информации, при электродиффузионной диагностике гидродинамич. течений,
в электроаналит. методах и во мн. смежных областях, включая биол. и мед.
исследования.
Лит.: Дамаскин Б.Б., Принципы современных методов изучения электрохимических реакций, М., 1965; Электрохимический импеданс, М., 1991; Proceedings of the first international symposium on electrochemical impedance spectroscopy, Oxf., 1990.
Б.М. Графов.

