Цирконий
ЦИРКОНИЙ (лат. Zirconium) Zr, хим. элемент IV гр. периодич. системы; ат. н. 40, ат. м. 91,224. Прир. Ц. состоит из 5 стабильных нуклидов: 90Zr (51,46%), 91Zr (11,23%), 92Zr (17,11%), 94Zr (17,40%) и 96Zr (2,80%). Поперечное сечение захвата тепловых нейтронов для прир. смеси 1,8 x 10-29 м2, для 91Zr 1,0 x 10-28 м2. Конфигурация внеш. электронных оболочек атома 4d25s2; степень окисления +4, значительно реже +3, +2 и +1; энергия ионизации при последоват. переходе от Zr0 к Zr4+ равна соотв. 6,837, 13,13, 22,98 и 34,92 эВ; электроотрицательность по Полингу 1,4; ионный радиус Zr4+ (в скобках даны координац. числа) 0,073 нм (4), 0,080 нм (5), 0,086 нм (6), 0,092 нм (7), 0,098 нм (8) или 0,103 нм (9).
Содержание Ц. в земной коре ок. 0,02% по массе. В своб. состоянии не встречается. Важнейшие минералы - циркон ZrSiO4, бадделеит ZrO2, эвдиалит (Na,Ca)6ZrOH(Si3O9)2(OH,Cl)2. Всего описано более 30 минералов Ц., каждый из к-рых содержит Hf, а многие - и радиоактивные примеси. Главные месторождения циркона расположены в США, Австралии, Малайзии, ЮАР, России, на Украине, бадделеита - в Бразилии, ЮАР, Шри-Ланке, России, эвдиалита - в Гренландии.
Свойства. Ц.- серебристо-серый блестящий (в порошкообразном состоянии - темно-серый) металл, высоко пластичен, легко поддается мех. обработке (ковка, штамповка, прокатка и др.), легко сваривается в инертной атмосфере. Существует в двух кристаллич. модификациях: а с гексагон. решеткой типа Mg, а = 0,3231 нм, с = 0,5146 нм, z = 2, пространств, группа Р6з/mmc, плотн. 6,5107 г/см3;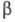 с кубич. решеткой типа a = Fe, а = 0,361 нм, z = 2, пространств. группа Im3m; т-ра перехода
с кубич. решеткой типа a = Fe, а = 0,361 нм, z = 2, пространств. группа Im3m; т-ра перехода 863 °С,
863 °С,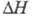 перехода 3,89 кДж/моль. Добавки Al, Sn, Pb, Cd повышают, a Fe, Cr, Ni, Mo, Cu, Ti, Mn, Co, V и Nb понижают т-ру перехода. Т. пл. 1855 °С, т. кип. ок. 4350 °С;
перехода 3,89 кДж/моль. Добавки Al, Sn, Pb, Cd повышают, a Fe, Cr, Ni, Mo, Cu, Ti, Mn, Co, V и Nb понижают т-ру перехода. Т. пл. 1855 °С, т. кип. ок. 4350 °С;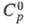 25,3 Дж/(моль x К);
25,3 Дж/(моль x К);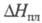 14,6 кДж/моль,
14,6 кДж/моль,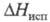 575 кДж/моль (1855 °С),
575 кДж/моль (1855 °С),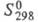 39,0 Дж/(моль x К); температурный коэф. линейного расширения (5,1-5,8) x 10-6К-1 (20-100 °С); теплопроводность 23,86 Вт/(м x К), ур-ния температурной зависимости теплопроводности
39,0 Дж/(моль x К); температурный коэф. линейного расширения (5,1-5,8) x 10-6К-1 (20-100 °С); теплопроводность 23,86 Вт/(м x К), ур-ния температурной зависимости теплопроводности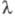 = 5,18009 x 10-1 - 2,367738 x 10-3T + 6,28905 x 10-6T2 - 5,58159 x 10-9T3 Вт/(м x К) (80-500 К),
= 5,18009 x 10-1 - 2,367738 x 10-3T + 6,28905 x 10-6T2 - 5,58159 x 10-9T3 Вт/(м x К) (80-500 К),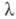 = 2,44486 x 10-1 - 2,3982 x 10-4T + 2,2721 x 10-7T2 -- 6,24923 x 10-11T3 Вт/(м x -К) (500-1900 К); p 43,74 мкОм x см (5 °С), температурный коэф. р 4,25 x 10-3К-1 (0-200 °С); работа выхода электрона 3,93 эВ. Модуль упругости 95-97 ГПа; sраст 380-510 МПа; твердость по Бринеллю 90-130, по Виккерсу 600-1700 МПа; относит. удлинение 25% (20 °С), относит. сжатие 45% (20 °С). Наличие примесей сильно меняет мех. св-ва Ц. Так, примеси О, С, Н придают ему хрупкость. Т-ра рекристаллизации Ц. 750 °С.
= 2,44486 x 10-1 - 2,3982 x 10-4T + 2,2721 x 10-7T2 -- 6,24923 x 10-11T3 Вт/(м x -К) (500-1900 К); p 43,74 мкОм x см (5 °С), температурный коэф. р 4,25 x 10-3К-1 (0-200 °С); работа выхода электрона 3,93 эВ. Модуль упругости 95-97 ГПа; sраст 380-510 МПа; твердость по Бринеллю 90-130, по Виккерсу 600-1700 МПа; относит. удлинение 25% (20 °С), относит. сжатие 45% (20 °С). Наличие примесей сильно меняет мех. св-ва Ц. Так, примеси О, С, Н придают ему хрупкость. Т-ра рекристаллизации Ц. 750 °С.
По хим. св-вам Ц. близок к Hf и в определенной степени к Ti.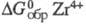 (р-р Н2О) -521,7 кДж/моль. При комнатной т-ре массивный Ц. обладает высокой коррозионной устойчивостью благодаря образованию на воздухе тонкой оксидной пленки. Ц. устойчив к действию НС1, HNO3, H2SO4, H3PO4 и щелочей. При нагр. медленно взаимод. с царской водкой, Н3РО4, H2SO4, фтористоводородной и щавелевой к-тами, с водными р-рами NH4F, с расплавл. NaHSO4, Na2CO3, Na2O2, NH4HF2, но с расплавл. NaOH взаимод. только с пов-сти, образуя черную пленку. Введение иона F- в к-ты резко усиливает их коррозионное действие на Ц.
(р-р Н2О) -521,7 кДж/моль. При комнатной т-ре массивный Ц. обладает высокой коррозионной устойчивостью благодаря образованию на воздухе тонкой оксидной пленки. Ц. устойчив к действию НС1, HNO3, H2SO4, H3PO4 и щелочей. При нагр. медленно взаимод. с царской водкой, Н3РО4, H2SO4, фтористоводородной и щавелевой к-тами, с водными р-рами NH4F, с расплавл. NaHSO4, Na2CO3, Na2O2, NH4HF2, но с расплавл. NaOH взаимод. только с пов-сти, образуя черную пленку. Введение иона F- в к-ты резко усиливает их коррозионное действие на Ц.
При нагр. выше 250 °С Ц. обратимо поглощает Н2, образуя гидриды и твердые р-ры, состав к-рых зависит от т-ры, давления Н2 и структуры исходного Ц. (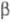 -фаза образует р-р, в пределе отвечающий составу ZrH0,25,
-фаза образует р-р, в пределе отвечающий составу ZrH0,25,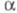 -фаза - составу ZrH0,05). Известен кубич. гидрид состава ZrH1,44_1,56 (
-фаза - составу ZrH0,05). Известен кубич. гидрид состава ZrH1,44_1,56 (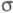 -фаза, плотн. 3,75 г/см3) и тетрагон, гидрид ZrH1,640-1, 965 (
-фаза, плотн. 3,75 г/см3) и тетрагон, гидрид ZrH1,640-1, 965 (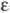 -фаза, плотн. 5,62 г/см3). Для кристаллич. ZrH2:
-фаза, плотн. 5,62 г/см3). Для кристаллич. ZrH2: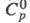 31,0 Дж/(моль x К);
31,0 Дж/(моль x К);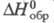 -169,2 кДж/моль;
-169,2 кДж/моль;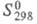 35,0 Дж/(моль x К). Гидриды Ц. проявляют металлич. св-ва. Их применяют для получения высокодисперсного Ц., как компонент керметов и пиротехн. составов. С галогенами Ц. образует циркония галогениды.
35,0 Дж/(моль x К). Гидриды Ц. проявляют металлич. св-ва. Их применяют для получения высокодисперсного Ц., как компонент керметов и пиротехн. составов. С галогенами Ц. образует циркония галогениды.
При т-рах выше 400-500 °С компактный Ц. взаимод. с О2 воздуха, образуя сначала тонкую пленку, затем твердые р-ры (a-фаза насыщается до состава ZrO0,29) или оксиды (Zr6O, Zr3O, ZrO2). Порошкообразный Ц. пирофорен и может служить геттером. Гексагон. Zr3O имеет т. пл. ок. 1975 °С. В газовой фазе существует ZrO. См. также Циркония диоксид. При действии щелочей на р-ры солей Zr(IV) образуется желатинообразный осадок ZrO2 x nH2O.
Выше 400 °С Ц. взаимод. с N2, образуя твердые р-ры или нитриды. Золотисто-желтый ZrN имеет кубич. кристаллич. решетку [пространств. группа FтЗт, т. пл. и т. возг. ок. 2990 °С, плотн. 7,3 г/см3, 40,4 ДжУ(моль-К),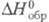 -371 кДж/моль,
-371 кДж/моль,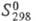 38,9 Дж/(моль x К)]. Коричневый Zr3N4 (плотн. 5,9 г/см3, твердость по Виккерсу 1300-1500 МПа), при 1000 °С разлагается до ZrN. Нитриды не раств. в воде, разлагаются царской водкой и горячими конц. к-тами (кроме H2SO4). Их получают из простых в-в или взаимод. ZrCl4 с NH3 при 700-900 °C; используют для получения керамики, композитов, антифрикционных, защитных и декоративных покрытий. Взаимод. простых в-в ок. 2000 °С получают циркония карбид.
38,9 Дж/(моль x К)]. Коричневый Zr3N4 (плотн. 5,9 г/см3, твердость по Виккерсу 1300-1500 МПа), при 1000 °С разлагается до ZrN. Нитриды не раств. в воде, разлагаются царской водкой и горячими конц. к-тами (кроме H2SO4). Их получают из простых в-в или взаимод. ZrCl4 с NH3 при 700-900 °C; используют для получения керамики, композитов, антифрикционных, защитных и декоративных покрытий. Взаимод. простых в-в ок. 2000 °С получают циркония карбид.
При т-рах выше 1500 °С Ц. взаимод. с В, образуя бориды: ZrB с кубич. кристаллич. решеткой (а = 0,465 нм, пространств. группа Fm3m); ZrB2 с гексагон. решеткой [т. пл. ок. 3050 °С, плотн. 6,1 г/см3,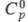 48,24 Дж/(моль x К),
48,24 Дж/(моль x К),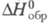 -328 кДж/моль,
-328 кДж/моль,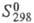 35,9 Дж/(моль x К)]; ZrB12 - кубич. кристаллы (а = 0,7408 нм, пространств. группа FтЗт, т. пл. ок. 2140 °С, плотн. 3,7 г/см3). Бориды проявляют металлич. св-ва, ZrB2 при взаимод. с к-тами выделяет небольшое кол-во Н2, а при взаимод. с H2SO4 - SO2. Для получения ZrB2 используют р-ции:
35,9 Дж/(моль x К)]; ZrB12 - кубич. кристаллы (а = 0,7408 нм, пространств. группа FтЗт, т. пл. ок. 2140 °С, плотн. 3,7 г/см3). Бориды проявляют металлич. св-ва, ZrB2 при взаимод. с к-тами выделяет небольшое кол-во Н2, а при взаимод. с H2SO4 - SO2. Для получения ZrB2 используют р-ции:
ZrCl4 + 2BBr3 + 5H2 ZrB2 + 4HC1 + 6НВг 7Zr + 3B4C+B2O3
ZrB2 + 4HC1 + 6НВг 7Zr + 3B4C+B2O3 7ZrB2 + 3CO
7ZrB2 + 3CO
Применяют ZrB2 как компонент инструментальных сплавов, керметов (в частности, для регулирующих стержней ядерных реакторов), огнеупоров, абразивов.
При нагр. Ц. с S образуются сульфиды: ZrS3 (оранжевые кристаллы моноклинной сингонии, плотн. 3,66 г/см3,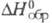 -611 кДж/моль); ZrS2 (т. пл. 1550 °С,
-611 кДж/моль); ZrS2 (т. пл. 1550 °С,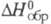 -567 кДж/моль); ZrS0,9_1,5 и ZrS0,7. С Se и Те Ц. дает аналогичные селениды и тeллуриды. Ц. образует фосфиды Zr3P, ZrP и ZrP2, арсениды ZrAs и ZrAs2, силициды Zr4Si, Zr2Si (плотн. 5,99 г/см3, т. пл. 1630 °С), Zr3Si2, Zr5Si4 (плотн. 5,90 г/см3, т. пл. 2210 °С), Zr6Si5 (т. пл. 2250 °С), ZrSi (плотн. 5,65 г/см3, т. пл. 2095 °С) и ZrSi2, германиды Zr3Ge, Zr5Ge3, ZrGe и ZrGe2 станниды Zr4Sn, Zr5Sn3, ZrSn2.
-567 кДж/моль); ZrS0,9_1,5 и ZrS0,7. С Se и Те Ц. дает аналогичные селениды и тeллуриды. Ц. образует фосфиды Zr3P, ZrP и ZrP2, арсениды ZrAs и ZrAs2, силициды Zr4Si, Zr2Si (плотн. 5,99 г/см3, т. пл. 1630 °С), Zr3Si2, Zr5Si4 (плотн. 5,90 г/см3, т. пл. 2210 °С), Zr6Si5 (т. пл. 2250 °С), ZrSi (плотн. 5,65 г/см3, т. пл. 2095 °С) и ZrSi2, германиды Zr3Ge, Zr5Ge3, ZrGe и ZrGe2 станниды Zr4Sn, Zr5Sn3, ZrSn2.
Ц. дает сплавы со мн. металлами. Небольшие добавки Ц. к др. металлам улучшают их св-ва (увеличивают прочность и коррозионную стойкость), в то время как добавки др. металлов к Ц., как правило, ухудшают св-ва Ц. и используются лишь для спец. сплавов (см. Циркония сплавы).
Ц. образует многочисленные соли и комплексные соед., в к-рых проявляет координац. числа 4-9, чаще 6-8. В водных р-рах соед. Ц. гидролизуются, хотя их склонность к гидролизу менее выражена, чем у соед. Ti. Даже в кислых р-рах многие соед. Ц. полимеризованы, с понижением кислотности степень полимеризации обычно возрастает, однако равновесия во мн. системах устанавливаются крайне медленно. Низшие степени окисления Ц. значительно менее устойчивы, чем у Ti.
Цирконаты - соли гипотетич. циркониевых к-т и металлов со степенью окисления от +1 до +4. Как правило, это тугоплавкие, нерастворимые в воде и щелочах в-ва. наиб. значение имеют метацирконаты состава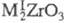 или
или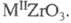 Метацирконат натрия Na2ZrO3 (т. разл. 1500 °С) и кальция CaZrO3 (структура перовскита, т. шт. 2550 °С, плотн. 4,95 г/см3) м. б. промежут. продуктами произ-ва Ц. Метацирконат бария BaZrO3 (кубич. кристаллич. решетка, т. пл. 2480 °С, плотн. 6,73 г/см3), стронция SrZrO3 (т. пл. выше 2700 °С, плотн. 5,00 г/см3) и свинца PbZrO3 (т. пл. 1570 °С) применяют для получения керамики и огнеупоров. Твердые р-ры PbZrO3 - PbTiO3 и BaZrO3 - BaTiO3 - диэлектрики и пьезозлектрики. Выделены дицирконаты
Метацирконат натрия Na2ZrO3 (т. разл. 1500 °С) и кальция CaZrO3 (структура перовскита, т. шт. 2550 °С, плотн. 4,95 г/см3) м. б. промежут. продуктами произ-ва Ц. Метацирконат бария BaZrO3 (кубич. кристаллич. решетка, т. пл. 2480 °С, плотн. 6,73 г/см3), стронция SrZrO3 (т. пл. выше 2700 °С, плотн. 5,00 г/см3) и свинца PbZrO3 (т. пл. 1570 °С) применяют для получения керамики и огнеупоров. Твердые р-ры PbZrO3 - PbTiO3 и BaZrO3 - BaTiO3 - диэлектрики и пьезозлектрики. Выделены дицирконаты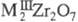 (
(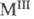 лантаноиды), трицирконаты
лантаноиды), трицирконаты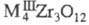 (
(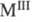 - Sc, Yb, Lu), TiZrO4 и др. Цирконаты получают спеканием ZrO2 или ZrSiO4 с карбонатами или оксидами соответствующих металлов, а также термич. разложением смесей нитратов или гидроксидов.
- Sc, Yb, Lu), TiZrO4 и др. Цирконаты получают спеканием ZrO2 или ZrSiO4 с карбонатами или оксидами соответствующих металлов, а также термич. разложением смесей нитратов или гидроксидов.
Тетрагидрат сульфата Ц. Zr(SO4)2 х4H2O имеет ромбич. кристаллич. решетку;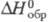 -3647 кДж/моль; раств. в воде (146 г в 100 г воды), хуже - в H2SO4. При нагр. до 100 °С переходит в моногидрат Zr(SO4)2 х H2O (
-3647 кДж/моль; раств. в воде (146 г в 100 г воды), хуже - в H2SO4. При нагр. до 100 °С переходит в моногидрат Zr(SO4)2 х H2O (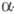 -модификация моноклинной сингонии,
-модификация моноклинной сингонии,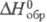 -2746 кДж/моль;
-2746 кДж/моль;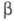 и
и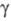 -триклинной), до 380 °С - в Zr2(SO4)2 (
-триклинной), до 380 °С - в Zr2(SO4)2 (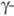 модификация ромбич. сингонии,
модификация ромбич. сингонии,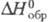 -2425 кДж/моль). Известны гидроксисульфаты Zr2(OH)2(SO4)3 х 4H2O, Zr(OH)2SO4 и др., сульфатоцирконаты щелочных металлов и аммония M4Zr(SO4)4 х nН2О. Сульфаты Ц. применяют как дубители кож.
-2425 кДж/моль). Известны гидроксисульфаты Zr2(OH)2(SO4)3 х 4H2O, Zr(OH)2SO4 и др., сульфатоцирконаты щелочных металлов и аммония M4Zr(SO4)4 х nН2О. Сульфаты Ц. применяют как дубители кож.
Из конц. р-ров HNO3 при т-рах ниже 15 °С выделяют нитрат Ц. состава Zr(NO3)4 x 5H2O, а при невысоких концентрациях HNO3 - состава ZrO(NO3)2 x 2H2O (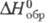 -1812 кДж/моль). Из р-ров выделены также ZrO(NO3)2 x nН2О, где п = 3, 3,5 и 6, Zr2O3(NO3)2, Zr4O7(NO3)2 и гидроксонитраты, напр. Zr(OH)2(NO3)2 x 4H2O. Все они при нагр. разлагаются, хорошо раств. в воде, метаноле и этаноле. Безводный нитрат получают по р-ции ZrCl4 + 4N2O5
-1812 кДж/моль). Из р-ров выделены также ZrO(NO3)2 x nН2О, где п = 3, 3,5 и 6, Zr2O3(NO3)2, Zr4O7(NO3)2 и гидроксонитраты, напр. Zr(OH)2(NO3)2 x 4H2O. Все они при нагр. разлагаются, хорошо раств. в воде, метаноле и этаноле. Безводный нитрат получают по р-ции ZrCl4 + 4N2O5 Zr(NO3)4 + 4NO2C1, он разлагается при наф. до 140 °С, но в виде адцукта с N2O5 перегоняется в вакууме.
Zr(NO3)4 + 4NO2C1, он разлагается при наф. до 140 °С, но в виде адцукта с N2O5 перегоняется в вакууме.
Из р-ров солей Zr(IV) осаждаются фосфаты, очень плохо р-римые в воде, но р-римые в конц. H2SO4 и Н2С2О4. Пирофосфат Ц. вьщеляется в виде гидрата ZrP2O7 x5H2O, к-рый обезвоживается при 700-1000 °С и превращается в Zr2P2O9 при 1500-1600 °С. При разл. значениях рН осаждаются также гидратированные Zr(HPO4)2, Zr3P4O16, Zr5P6O25, Zr5P8O30, к-рые при 1000-1400 °С также переходят в ZrP267 или его смеси с ZrO2. Фосфаты Ц. применяют как коагулянты, носители радиоактивного Р. Существуют фосфатоцирконаты щелочных металлов, образующиеся в водной среде или в расплавах.
Силикат Ц. ZrSiO4 (прир. минерал циркон)кристаллизуется в тетрагон, решетке (пространств. группа I4/amd); плотн. 4,7 г/см3; разлагается при 1680 °С; С0p 98,3 Дж/(моль x К);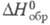 -2033 кДж/моль;
-2033 кДж/моль;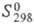 841 Дж/(моль x К); не раств. в воде. Прир. циркон м. б. бесцветным, янтарным (гиацинт), голубым, зеленым и черным. Отдельные разности применяют как драгоценные камни, однако большую часть добываемого циркона используют как огнеупорный материал, компонент керамики, стекол, глазурей, эмалей, а также как сырье для произ-ва металлич. Ц. и его соединений.
841 Дж/(моль x К); не раств. в воде. Прир. циркон м. б. бесцветным, янтарным (гиацинт), голубым, зеленым и черным. Отдельные разности применяют как драгоценные камни, однако большую часть добываемого циркона используют как огнеупорный материал, компонент керамики, стекол, глазурей, эмалей, а также как сырье для произ-ва металлич. Ц. и его соединений.
Ц. не образует карбонатов, выделены только оксо- и гидроксокарбонаты. Известны также цирконийорганические соединения.
Получение. Цирконовые руды обогащают гравитационными методами, магн. и электрич. сепарацией до содержания ZrO2 не менее 60 или 65% по массе; концентраты часто подвергают предварит. хим. обогащению для удаления Fe. Осн. способы получения Ц. из концентратов - фторидный, хлоридный и щелочной (известковый, содовый). Фторидный способ включает спекание цирконовых концентратов с K2SiF6 при 600-700 °С (ZrSiO4 + K2SiF6 K2ZrF6 + 2SiO2), выщелачивание K2ZrF6 вместе с K2HfF6 горячей подкисленной водой, разделение K2ZrF6 и K2HfF6 на неск. стадиях перекристаллизации и послед. электролитич. восстановление в расплаве K2ZrF6 - NaCl - КС1.
K2ZrF6 + 2SiO2), выщелачивание K2ZrF6 вместе с K2HfF6 горячей подкисленной водой, разделение K2ZrF6 и K2HfF6 на неск. стадиях перекристаллизации и послед. электролитич. восстановление в расплаве K2ZrF6 - NaCl - КС1.
При хлоридном методе хлорируют либо концентраты в присут. кокса при 900-1000 °С, либо карбиды (карбонитриды), полученные из концентратов, при 400-900 °С, затем проводят десублимацию ZrCl4 и его восстановление Mg с получением губчатого Ц. При необходимости произ-ва чистого (без Hf) Ц. первичный ZrCl4 гидролизуют водой, очищают в р-рах методом жидкостной экстракции, полученный ZrO2 вновь хлорируют и затем получают губку.
Щелочной метод включает спекание с NaOH (600-650 °С), Na2CO3 (900-1100 °С) или со смесью СаСО3 и СаС12 (1000-1300 °С), послед. кислотное выщелачивание Na2ZrO3 или CaZrO3, гидролиз очищенных р-ров ZrOCl2 или H2ZrO(SO4)2 и прокаливание осадков до ZrO2, к-рый затем превращают в хлорид или K2ZrF6.
Описанные способы имеют много разновидностей. Так, для произ-ва чистого (без Hf) Ц. выщелачивание известкового спека ведут HNO3, после чего проводят экстракционную очистку с помощью трибутилфосфата. В нек-рых произ-вах используют экстракцию метилизобутилкетоном из роданидных р-ров или аминами из сульфатных р-ров. Из очищенных нитратных р-ров Ц. осаждают в виде ZrF4 хH2O, к-рый прокаливают в токе HF и подвергают кальциетермич. восстановлению с получением слитков пластичного Ц.
Экономичный способ произ-ва ZrO2 - термич. разложение ZrSiO4 в плазме с послед. выщелачиванием SiO2 р-рами NaOH. наиб. чистый Zr (т. наз. иодидный Ц.) получают термич. разложением ZrI4 (см. Химическое осаждение из газовой фазы).
Компактный Ц. получают прессованием и послед. переплавлением губки, катодной груши или прутка иодидного Ц. в вакуумных электродуговых или электроннолучевых печах. Рафинирование Ц. ведут иодидным методом (см. Химические транспортные реакции), реже - электролитически.
Определение. Аналит. химия Ц. ограничена соед. Zr(IV). Качественно Ц. обнаруживают по красно-коричневому осадку при добавлении р-ра n-диметиламиноазофениларсоновой к-ты в 1-2 н. НС1 в присут. Н2О2. Руфигаллол (гексагидроксиантрахинон) в р-ре НС1 дает в присут. Ц. пурпурно-фиолетовую окраску (в присут. Hf - слабо-розовую). Количеств. методы: гравиметрический (прокаливание до ZrO2 после осаждения миндальной к-той или до ZrP2O7 после осаждения ионами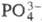 ); волюмометрический (комплекснометрич. титрование трилоном Б в соляной к-те, определяются 50-90%-ные концентрации Ц. в пробе); спектрофотометрический (с добавками ализарина красного S при длине волны 550 мкм, пирокатехинового фиолетового при 650 мкм или др.); рентгенофлюоресцентный (0,1-50% Ц.), спектральный (0,3-2,5% Ц.); атомно-абсорбционный (0,1-3% Ц.); по эмиссионным спектрам (следовые кол-ва); радиометрический и др.
); волюмометрический (комплекснометрич. титрование трилоном Б в соляной к-те, определяются 50-90%-ные концентрации Ц. в пробе); спектрофотометрический (с добавками ализарина красного S при длине волны 550 мкм, пирокатехинового фиолетового при 650 мкм или др.); рентгенофлюоресцентный (0,1-50% Ц.), спектральный (0,3-2,5% Ц.); атомно-абсорбционный (0,1-3% Ц.); по эмиссионным спектрам (следовые кол-ва); радиометрический и др.
Применение. Металлич. Ц. и его сплавы - конструкционные материалы ядерных реакторов (оболочки твэлов, сборки, трубы, трубные решетки и т.п.), хим. аппаратов. Высокая коррозионная стойкость и совместимость с биол. тканями позволяют использовать Ц. для изготовления искусств. суставов и протезов. Сплав Ц. с Nb применяют для изготовления колпачков натриевых ламп высокого давления, обмоток сверхпроводниковых магнитов.
Мировое произ-во Ц. составляет 800-900 тыс. т в год (1988), большая часть приходится на ZrO2, ZrSiO4 и др. соед. и лишь неск. процентов - на металл и сплавы. Осн. производители концентратов Ц.- Австралия, ЮАР, Россия, Украина, США.
ПДК в воздухе рабочей зоны для Zr, ZrO2, ZrSiO4, ZrC 6 мг/м3, для ZrN 4 мг/м3 (класс опасности 3), для фтороцирконатов(IV) 1 мг/м3 (класс опасности 2). ЛД50 (мг/кг, перорально) для K2ZrF6 2500 (крысы), 97,5 (мыши); ZrOCl2 990 (крысы); Na2ZrO3 2290 (крысы); ZrCl4 1688 (крысы), 400 (мыши). Осн. источники поступления Ц. в окружающую среду - пылевые и дымовые выбросы топливно-энергетич. предприятий, работающих на угле и нефти, угольная пыль.
В 1789 М. Клапрот выделил ZrO2, в 1824 Й. Берцелиус получил загрязненный порошкообразный металл, в 1925 А. ван Аркель - чистый компактный металл.
Лит.: 3отова 3. А., Современное состояние технологии переработки цирконовых концентратов за рубежом, М., 1976; Займовский А. С., Никулина А. В., Решетников Н. Г., Циркониевые сплавы в атомной энергетике, М., 1981; Колотыркин Я. М. [и др.], "Хим. пром-сть", 1986, № 3, с. 161-63; Витязь П. А. [и др.], "Порошковая металлургия", 1989, № 12, с. 45-50; Clark R. J. H., Bradley D. С, Thоrnton P., The chemistry of titanium, zirconium and hafnium, Oxf.- [a. o.], 1975; Ferrando W.A., "Adv. materials and manufacturing processes", 1988, v. 3, № 2, p. 195-231.
Э. Г. Раков.

