Циклоприсоединение
ЦИКЛОПРИСОЕДИНЕНИЕ, р-ции, протекающие
с образованием нового цикла из двух реагирующих молекул (без отщепления
к.-л. групп или атомов); сопровождаются общим уменьшением кратности связей.
К Ц. относят также внутримол. взаимод. двух фрагментов молекулы. Классифицируют
р-ции по числу атомов каждого компонента, участвующих в образовании цикла
[обозначают (2 + 1)-, (2 + 2)-, (3 + 2) Ц. и т. д.; иногда указывают индексами
стереохимию Ц., напр., (4s + 2s)-Ц., см. Вудворда-Хофмана
правила]; реже - по числу вовлекаемых электронов с указанием
типа орбитали, напр.,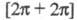 или
или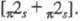
В (2 + 1)-Ц. к молекуле, содержащей кратную
связь, присоединяется атом, имеющий одновременно заполненную и вакантную
орбитали; в результате образуется трехчленный цикл. Протекает по согласованному
механизму (см. Согласованные реакции). В р-ции могут участвовать
моно- и полиены, полиины, напр.:
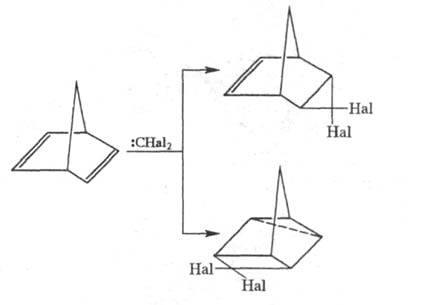
Ц. дигалогенкарбенов к норборнадиену протекает по двум направлениям с образованием продуктов 1,2- и 1,3-присоединения:
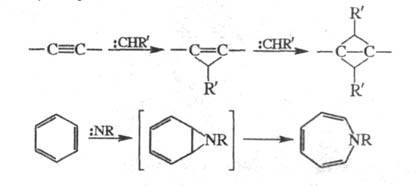
Ц. дифторкарбена к циклопентадиену - пром. метод получения фторбензола:
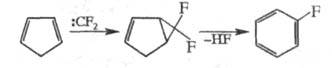
Аналогично получают 2-фторнафталин из индена
и 2,3-дифторнафталин из стирола.
(2 + 2)-Ц. приводит к образованию четырехчленных
циклов. Механизм р-ций и эксперим. условия их проведения зависят от электронного
строения реагирующих в-в. Ц. олефинов, один из к-рых имеет электронодефицитную
[напр., (CN)2C = C(CF3)C1, (CN)2C = C(CN)2,
(CF3)2C = C(CN)2, CH2=CHCOOR,
CH2 = CHNO2], а другой - электроно-обогащенную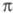 -связь
(напр., CH2 = CHOR, CH2 = CHNR2, n-CH3OC6H4CH
= CH2), протекает обычно в мягких условиях с высокими выходами
через промежут. образование цвиттер-иона. Стереоселективность (определяется
наиб. устойчивым цвиттер-ионом) и скорость р-ции резко возрастают с увеличением
полярности р-рителя. Так, при взаимод. цис-анетола с тетрацианоэтиленом
в среде циклогексана продукт р-ции содержит 10-15% транс-изомера, в среде
ацетонигрила - 49%, при этом в последнем случае скорость р-ции возрастает
в 6, 3 х 104 раза (из транс-анетола даже в сильно полярных
р-рителях образуется только трансизомер):
-связь
(напр., CH2 = CHOR, CH2 = CHNR2, n-CH3OC6H4CH
= CH2), протекает обычно в мягких условиях с высокими выходами
через промежут. образование цвиттер-иона. Стереоселективность (определяется
наиб. устойчивым цвиттер-ионом) и скорость р-ции резко возрастают с увеличением
полярности р-рителя. Так, при взаимод. цис-анетола с тетрацианоэтиленом
в среде циклогексана продукт р-ции содержит 10-15% транс-изомера, в среде
ацетонигрила - 49%, при этом в последнем случае скорость р-ции возрастает
в 6, 3 х 104 раза (из транс-анетола даже в сильно полярных
р-рителях образуется только трансизомер):
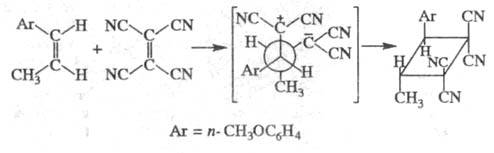
Ц. фгоролефинов протекает при т-ре 100 °С и повышенном давлении через бирадикальные интермедиаты, от устойчивости к-рых зависит направление р-ции (р-ция не носит цепного характера, не ингибируется и не инициируется), напр.:
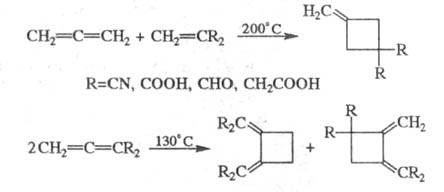
Аналогично протекает Ц. кумуленов и олефинов и их димеризация:
Ц. кетенов и др. гетерокумуленов (кетениминов R2C = C = NR, тиокетенов R2C = C = S, карбодиимидов RN = C = NR, изоцианатов RN = C = O) протекает через ассоциативное переходное состояние (по принципу "голова к хвосту") со слабо выраженным разделением зарядов и приводит к образованию производных циклобутанона; р-ции высокостереоспецифичны, скорость их слабо возрастает при увеличении полярности р-рителя:
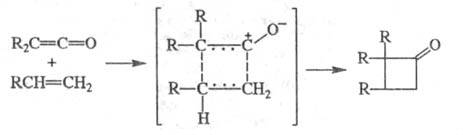
При димеризации кетенов (но не самого кетена)
образуются циклобутанд ионы.
Фотохим. сенсибилизир. Ц. алкенов может
протекать нестереоспецифично либо как согласованный стереоспецифич.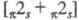 -процесс, приводящий к образованию в случае сим-алкенов смеси двух изомеров,
напр.:
-процесс, приводящий к образованию в случае сим-алкенов смеси двух изомеров,
напр.:
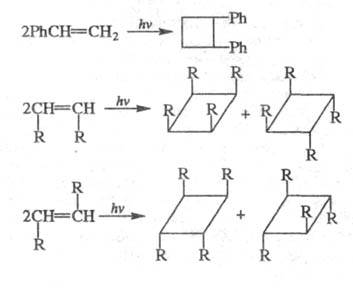
При Ц. алкинов образуются циклобутены.
Фотохим. Ц. с участием енонов широко используют
в синтезе прир. соед., напр. терпенов. Для этих же целей применяют внутримол.
Ц.; последнее - ключевая стадия при получении полиэдрических соединений.
Фотохим. Ц. по карбонильной группе альдегидов или кетонов с олефинами
приводит к оксетанам (см. Патерно-Бюхи реакция).
(3 + 2)-Ц. (чаще наз. 1,3-диполярным
Ц.) - присоединение к молекуле, содержащей кратную связь, 1,3-диполярных
соед.- трехатомных компонентов (разл. комбинации атомов С, О, N), обладающих
4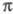 -электронами,
с образованием 5-членных гетероциклов. В качестве 1,3-диполярных соед.
используют диазосоединения, азиды, азоксисоединения либо малостабильные
нитрилоксиды, нитриламины, нитроны и др., вводимые в р-цию в момент образования,
напр.:
-электронами,
с образованием 5-членных гетероциклов. В качестве 1,3-диполярных соед.
используют диазосоединения, азиды, азоксисоединения либо малостабильные
нитрилоксиды, нитриламины, нитроны и др., вводимые в р-цию в момент образования,
напр.:
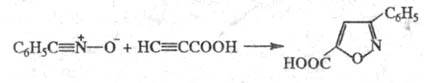
Р-ция высокостереоспецифична, почти не
чувствительна к полярности р-рителя. Большинство данных указывает на согласованный
механизм в соответствии с правилами сохранения орбитальной симметрии; нек-рые
р-ции, возможно, протекают ступенчато (напр., через бирадикальные интермедиаты).
Р-ции, в к-рых участвуют аллильные производные,
наз. "анионным" Ц., напр.:
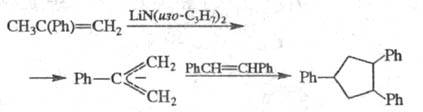
Благодаря высокой регио- и стереоселективности
анионное Ц. используют в синтезе макроциклич. антибиотиков и прир. соединений.
(4 + 2)-Ц. (р-ция Дильса-Альдера) - присоединение
соед. с сопряженными кратными связями к соед. с активир. кратной связью
с образованием 6-членных циклов (см. Диеновый синтез).
Известны др. типы Ц.: (4 + 1)-Ц., напр.
взаимод. бутадиена с SO2 - пром. метод синтеза 3-сульфолена
(см. Сулъфолены); (4 + 4)-Ц., напр. фотохим. димеризация
антрацена и др. Тримол. р-ции Ц., как правило, многоступенчатые процессы.
Р-ции, обратные Ц., наз. циклоэлиминированием,
циклореверсией, ретро-Ц.
Ц. широко используют в орг. химии для
синтеза карбо- и гетероциклич. соед. с разл. набором и числом атомов в
кольце; оно представляет большой теоретич. интерес.
Лит.: Джилкрист Т., Сторр Р., Органические реакции и орбитальная симметрия, пер. с англ.,М., 1976, с. 101-36, 146-62, 165-70, 184-224, 231-44; Общая органическая химия, пер. с англ., т. 1, М., 1981; Мар ч Дж., Органическая химия, пер. с англ., т. 3, М., 1987, с. 234-69; Trost B.M., "Angew. Chem.", 1986, Jahr. 98, Hf. 1, S. 1-114.
В. Р. Скварченко.

