Цепные реакции
ЦЕПНЫЕ РЕАКЦИИ, хим. превращения
и ядерные процессы, в к-рых появление промежуточной активной частицы (свободного
радикала, атома, возбужденной молекулы в хим. превращениях, нейтрона -
в ядерных процессах) вызывает цепь превращений исходных в-в. Примеры хим.
Ц. р.- радикальная полимеризация, окисление, пиролиз и галогенирование
углеводородов и др. орг. соед.; ядерные цепные процессы - цепное деление
атомных ядер. Данная статья посвящена в основном химическим цепным реакциям.
Термин "Ц.р." был предложен М. Боденштейном,
обнаружившим (1913), что в ряде фотохим. р-ций (напр., Н2 +
+ С12 2НС1, СО + С12
2НС1, СО + С12 СОС12)
один поглощенный фотон вызывает превращение сотен тысяч молекул. Поскольку
согласно закону квантовой эквивалентности Штарка-Эйнштейна при поглощении
одного фотона в р-цию вступает лишь одна частица, остальные молекулы реагируют
без непосредственного светового воздействия. Боденштейн предположил, что
активной частицей, вызывающей цепь превращений, является возбужденная молекула
СОС12)
один поглощенный фотон вызывает превращение сотен тысяч молекул. Поскольку
согласно закону квантовой эквивалентности Штарка-Эйнштейна при поглощении
одного фотона в р-цию вступает лишь одна частица, остальные молекулы реагируют
без непосредственного светового воздействия. Боденштейн предположил, что
активной частицей, вызывающей цепь превращений, является возбужденная молекула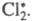 В 1916 В. Нернст высказал предположение об атомарной природе активных частиц
и предложил след, механизм Ц. р. с участием Сl2. Поглощение
фотона приводит к образованию из молекулы С12 двух атомов
В 1916 В. Нернст высказал предположение об атомарной природе активных частиц
и предложил след, механизм Ц. р. с участием Сl2. Поглощение
фотона приводит к образованию из молекулы С12 двух атомов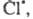 к-рые вступают последовательно в р-ции:
к-рые вступают последовательно в р-ции:
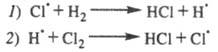
Суммирование р-ций 7 и 2 дает брутто-р-цию,
к-рая отражает стехиометрию превращения Н2 + С12 2НС1.
Атом
2НС1.
Атом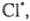 образовавшийся в р-ции 2, идентичен атому
образовавшийся в р-ции 2, идентичен атому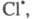 вступившему
в р-цию 7, поэтому последовательность р-ций можно представить в виде, иллюстрирующем
наглядность термина "Ц. р.":
вступившему
в р-цию 7, поэтому последовательность р-ций можно представить в виде, иллюстрирующем
наглядность термина "Ц. р.":
Цепной механизм и его стадии
Ц. р. относятся к сложным реакциям и
могут состоять из мн. элементарных стадий. Любая Ц. р. обязательно включает
три осн. стадии: инициирование (зарождение цепи), продолжение и обрыв цепи.
Инициированием наз. стадия, в к-рой из валентнонасыщенных молекул исходных
в-в образуются переносчики цепи- активные частицы, участвующие в последующих
р-циях и приводящие в конце концов к расходованию исходных в-в и образованию
продуктов (р-ции инициирования в дальнейшем обозначаются буквой i).
Последоват. р-ции (стадии) продолжения цепи составляют т. наз. цикл продолжения
цепи (ЦПЦ), или звено цепи, а число v звеньев, приходящихся в среднем
на каждый образовавшийся в р-ции инициирования переносчик цепи, наз. длиной
цепи. Переносчики цепи исчезают в р - циях обрыва цепи вследствие столкновений
друг с другом или со стенкой реакционного сосуда (в дальнейшем р-ции обрыва
обозначаются буквой о).
В нек-рых Ц. р. в одной или неск. элементарных
стадиях происходит увеличение числа активных частиц, что приводит к разветвлению
цепей; такие Ц. р. наз. разветвленными.
Рассмотрим подробнее стадии Ц. р.
Инициирование - наиб. энергоемкая
стадия Ц. р., ее энергия активации определяется энергией разрываемой хим.
связи (обратная р-ция - безактивационная). Поэтому образование активных
частиц из молекул исходных в-в происходит лишь при достаточно высоких т-рах
или при воздействии света, ионизирующего излучения, ускоренных электронов
и т. п.
В отсутствие энергетич. воздействия образование
активных частиц и инициирование Ц. р. может происходить при обычных т-рах
лишь в присутствии инициаторов - в-в, в молекулах к-рых энергия разрыва
хим. связи существенно меньше, чем в молекулах исходных в-в. Типичные инициаторы
- орг. пероксиды и гидропероксиды, диазосоединения (см. Инициаторы радикальные).
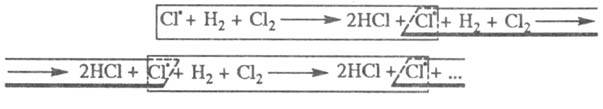
Переносчики цепи образуются при последующих р-циях радикалов с молекулами
реагентов, напр.:
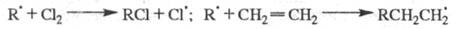
В газофазных системах инициирование может протекать также на стенке сосуда S в результате диссоциативной хемо-сорбции реагента, напр.:
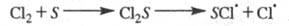
Энергия активации такой р-ции меньше, чем
р-ции в объеме на величину разницы теплот адсорбции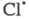 и
С12.
и
С12.
В р-рах инициирование может происходить
в результате переноса электронов, обычно в р-ции участвуют ионы переходного
металла. Инициатором мн. Ц. р. служит, напр., реактив Фентона H2O2
- FeSO4 (активные частицы образуются
в р-ции
образуются
в р-ции
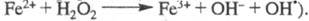
Инициаторы ускоряют образование активных частиц, т. е. являются катализаторами инициирования, но в отличие от катализаторов обычных (нецепных) процессов они расходуются (часто их наз. расходуемыми катализаторами).
Продолжение цепи м. б. проиллюстрировано
на примере процессов фотохим. разложения Н2О2 в присут.
ионов Cu2+ и каталитич. разложения Н2О2
при добавлении в р-р ионов Fe3+, к-рые имеют схожие цепные механизмы
(переносчики цепи -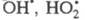 и Сu+ или Fe2+):
и Сu+ или Fe2+):
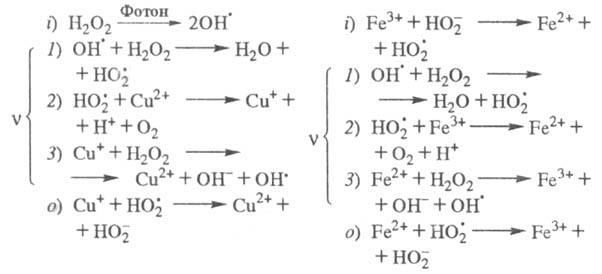
Представляют интерес р-ции ЦПЦ в нек-рых важнейших пром. процессах. Так, для хлорирования орг. соединений ЦПЦ имеет вид:
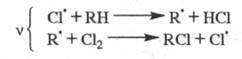
Для окисления орг. соединений:
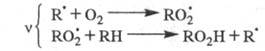
Для крекинга насыщенных углеводородов, напр. бутана:
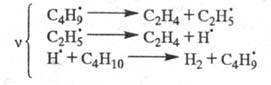
Для радикальной полимеризации олефинов:
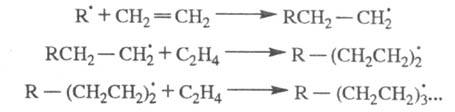
Многие атмосферные процессы относятся к
Ц. р. Напр., в процессах соокисления метана и NO, образования H2SO4
в облачных каплях, содержащих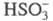 (кислотные дожди), ЦПЦ имеют вид:
(кислотные дожди), ЦПЦ имеют вид:
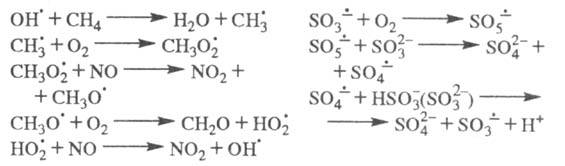
Стратосферные процессы разложения озона
под действием
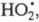


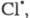
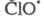 также рассматриваются на основе представлений о Ц. р. и их стадиях; в частности
также рассматриваются на основе представлений о Ц. р. и их стадиях; в частности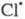 и
и образуются из хладонов, их присутствие в стратосфере считается одним из
осн. факторов, ведущих к наблюдаемому уменьшению концентрации стратосферного
озона.
образуются из хладонов, их присутствие в стратосфере считается одним из
осн. факторов, ведущих к наблюдаемому уменьшению концентрации стратосферного
озона.
В период становления осн. понятий теории
Ц. р. в качестве активных частиц рассматривались лишь атомы и своб. радикалы.
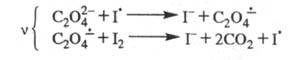
В 30-х гг. Н. Н. Семенов предложил механизм Ц. р. с участием ион-радикалов
и возбужденных молекул. Так, для окисления щавелевой к-ты иодом предложена
след. цепь:
Для разложения озона предполагалась
цепь с участием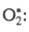
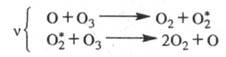
Впоследствии в число переносчиков цепи
вошли и др. частицы: бирадикал (окисление
Н2), ионы переходных металлов в нестабильных (для условий опыта)
зарядовых состояниях, комплексные соед. в конформационно-неравновесных
состояниях и т. п. высокореакционные частицы.
(окисление
Н2), ионы переходных металлов в нестабильных (для условий опыта)
зарядовых состояниях, комплексные соед. в конформационно-неравновесных
состояниях и т. п. высокореакционные частицы.
Обрыв цепи. Гибель переносчиков
цепи при столкновениях со стенкой S реакционного сосуда происходит
по механизму типа: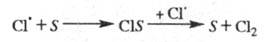
В этих случаях скорость р-ции обрыва пропорциональна
концентрации своб. радикалов - т. наз. линейный обрыв. Чем больше отношение
площади пов-сти сосуда к его объему, тем интенсивнее гибель переносчиков
цепи на стенке, тем короче цепь и меньше скорость р-ции.
Обрыв цепи вследствие столкновений радикалов
- переносчиков цепи друг с другом и взаимного насыщения своб. валентности
в объеме сосуда обычно происходит с участием третьей частицы М, роль к-рой
состоит в отводе энергии от образующейся частицы:
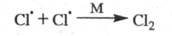
В этих случаях обрыв цепи является р-цией
второго порядка по концентрации своб. радикалов, а ее скорость пропорциональна
произведению их концентраций - т. наз. квадратичный обрыв.
Линейный обрыв цепи возможен и вследствие
хим. взаимод. переносчиков цепи с примесным в-вом, если при этом образуется
радикал, не участвующий в р-циях продолжения цепи. Так, переносчик цепи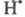 реагирует
с примесным О2 с образованием
реагирует
с примесным О2 с образованием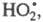 к-рый не участвует в р-циях продолжения цепи и исчезает при столкновении
с др. частицей
к-рый не участвует в р-циях продолжения цепи и исчезает при столкновении
с др. частицей или с атомами
или с атомами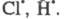
Важнейший характерный признак Ц. р.- обрыв
цепей на молекулах ингибитора- в-ва, эффективно взаимодействующего с переносчиком
цепи и дезактивирующего его в результате хим. превращения. Выше упоминался
О2, дезактивирующий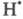 переводом его в форму
переводом его в форму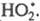 В случае введения в хим. систему т. наз. слабого ингибитора Ц. р. длительное
время протекает медленнее, чем в его отсутствие. При добавке т. наз. сильного
ингибитора Ц. р. практически не наблюдается в течение нек-рого периода
индукции, после чего ее скорость становится такой же, как и без ингибитора
(подробнее см. в ст. Ингибиторы). В отд. группу выделяют ингибиторы
цепного окисления орг. в-в - т. наз. антиоксиданты. Эффективными
прир. антиоксидантами являются аскорбиновая к-та и токоферол.
В случае введения в хим. систему т. наз. слабого ингибитора Ц. р. длительное
время протекает медленнее, чем в его отсутствие. При добавке т. наз. сильного
ингибитора Ц. р. практически не наблюдается в течение нек-рого периода
индукции, после чего ее скорость становится такой же, как и без ингибитора
(подробнее см. в ст. Ингибиторы). В отд. группу выделяют ингибиторы
цепного окисления орг. в-в - т. наз. антиоксиданты. Эффективными
прир. антиоксидантами являются аскорбиновая к-та и токоферол.
Кинетические закономерности неразветвленных Ц.р.
В начальный момент времени концентрация
переносчиков цепи в реагирующей хим. системе равна нулю. При введении инициатора
или при энергетич. воздействии на систему начинается образование переносчиков
цепи со скоростью инициирования wi. Одновременно происходят
р-ции продолжения цепи, к-рые характеризуются относительно небольшими энергиями
активации, и практически безактивационный процесс обрыва цепи на стенке
или в объеме сосуда. Если р-ции на стенке являются основным каналом и инициирования
и обрыва цепи, то скорость Ц. р. не зависит от отношения площади пов-сти
сосуда S к его объему V, как и в том случае, если и инициирование
и обрыв цепи происходят в объеме; в иных случаях скорость Ц. р. зависит
от отношения S/V.
Обычно ЦПЦ состоит из 2-3 и более р-ций,
причем одна из них характеризуется большей (сравнительно с другими) энергией
активации и является скоростьопределяющей (лимитирующая стадия). Ее скорость
равна скоростям всех остальных р-ций ЦПЦ wпр, но концентрация
радикалов, участвующих в этой лимитирующей стадии, наибольшая. Т. к. гибель
радикалов является практически безактивационным процессом, то осн. вклад
в обрыв цепи вносят радикалы, участвующие в лимитирующей стадии ЦПЦ.
Участие переносчиков цепи в ЦПЦ не влияет
на их концентрацию в системе, т. к. в ЦПЦ происходит их регенерация. Число
переносчиков цепи п в единице объема в каждый момент времени t
в простейшем случае гибели на стенке выражается дифференц. ур-нием:

откуда

где g - т. наз. фактор гибели переносчиков цепи (фактор обрыва цепи), равный константе скорости kо обрыва цепи на стенке. Из (2) следует, что п = 0 при t = 0 и со временем п достигает значения wi /kо. Скорость Ц. p. w пропорциональна п и возрастает от w = 0 до значения, определяемого выражением:

где [А] - концентрация реагента, подвергающегося
превращению по цепному механизму; kпр - константа
скорости продолжения цепи.
Различают два режима протекания процесса;
нестационарный, соответствующий периоду роста скорости w, и стационарный,
при к-ром п и w имеют постоянные значения. Характерные значения
kо - десятки с-1, поэтому, согласно (2), период
нестационарности характеризуется обычно долями секунды.
Если длина цепи v мала, в выражении
для скорости р-ции необходимо учесть скорость расходования реагентов в
стадии инициирования и скорость возможного образования продуктов в стадии
обрыва цепи. Обычно, однако, число v составляет десятки, сотни и
тысячи и скорость Ц. р. практически равна скорости каждой из р-ций продолжения
цепи, согласно выражению (3).
При введении ингибитора In возникает дополнит,
канал гибели переносчиков цепи (константа скорости
kIn)
и скорость Ц. р. принимает значение w':
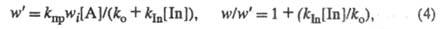
где [In] - концентрация ингибитора. Если
kIn невелика, для заметного замедления Ц. р. необходима
добавка ингибитора в такой концентрации [In], чтобы значения
kIn[In]
и ko были соизмеримы. Расход ингибитора будет происходить
со скоростью, меньшей wi, а т. к. его начальная концентрация
[In]0 -существенная величина, ее уменьшение в ходе р-ции м.
б. небольшим. Соответственно р-ция будет протекать длительное время со
скоростью, равной или близкой к значению, определяемому выражением (4),
где [In]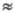 [In]0.
Если же константа скорости kIn велика настолько,
что уже при малых [In] о произведение
[In]0.
Если же константа скорости kIn велика настолько,
что уже при малых [In] о произведение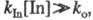 то в течение нек-рого времени, пока выполняется это неравенство, скорость
образования продукта будет ничтожно мала в сравнении со скоростью Ц. р.
w в отсутствие ингибитора. По мере расходования In, протекающего практически
со скоростью инициирования wi, скорость Ц. р. в присут.
ингибитора w' достаточно быстро достигнет значения w.
то в течение нек-рого времени, пока выполняется это неравенство, скорость
образования продукта будет ничтожно мала в сравнении со скоростью Ц. р.
w в отсутствие ингибитора. По мере расходования In, протекающего практически
со скоростью инициирования wi, скорость Ц. р. в присут.
ингибитора w' достаточно быстро достигнет значения w.
Расчет скорости Ц. р. в общем случае производится
по методу квазистационарных концентраций (см. Квазистационарности приближение).
Этот метод применим к частицам, концентрации к-рых из-за высокой реакционной
способности на много порядков меньше концентраций реагентов. Для каждого
из переносчиков цепи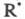 составляют дифференц. ур-ние, приравнивающее производную
составляют дифференц. ур-ние, приравнивающее производную к сумме скоростей всех р-ций, в к-рых
к сумме скоростей всех р-ций, в к-рых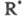 образуется и гибнет. Все производные полагают равными нулю и решают систему
алгебраич. ур-ний согласно методу Боденштейна.
образуется и гибнет. Все производные полагают равными нулю и решают систему
алгебраич. ур-ний согласно методу Боденштейна.
Другой способ расчета скорости используют
для Ц. р. с длинами цепи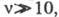 когда можно пренебречь возможным вкладом скоростей инициирования и обрыва
цепи в общую скорость р-ции, т. е. в тех случаях, когда общая скорость
w
равна скорости wпр р-ций ЦПЦ (все они имеют одинаковую
скорость) и wi = w0. Стационарную концентрацию
переносчиков цепи, участвующих в р-циях обрыва, определяют из кинетич.
ур-ния wi = w0 и затем рассчитывают
w. Так, для вышеупомянутого разложения Н2О2
в присуг. ионов Сu2+ при освещении светом интенсивности I
когда можно пренебречь возможным вкладом скоростей инициирования и обрыва
цепи в общую скорость р-ции, т. е. в тех случаях, когда общая скорость
w
равна скорости wпр р-ций ЦПЦ (все они имеют одинаковую
скорость) и wi = w0. Стационарную концентрацию
переносчиков цепи, участвующих в р-циях обрыва, определяют из кинетич.
ур-ния wi = w0 и затем рассчитывают
w. Так, для вышеупомянутого разложения Н2О2
в присуг. ионов Сu2+ при освещении светом интенсивности I
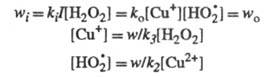
Отсюда
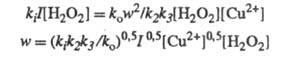
Разветвленные Ц.р.
Термин предложен Н. Н. Семеновым для открытых
им (1926-28) Ц. р. с критич. явлениями, состоящими в том, что незначит.
изменения концентрации реагентов, т-ры, размеров сосуда, введение примеси
(даже разбавление реакционной смеси инертным газом) могут приводить к скачкообразному
росту скорости Ц. р. от практически ненаблюдаемой до столь большой, что
ее невозможно измерить. Впервые критич. явления в хим. системах были обнаружены
Семеновым, Ю. Б. Харитоном и 3. Ф. Вальта при окислении паров фосфора.
Термином "разветвление" обозначают входящую в такие р-ции стадию размножения
активных частиц.
Осн. понятие теории разветвленных Ц. р.-
фактор разветвления цепи f, противоположный фактору гибели
g
переносчиков цепи в р-циях обрыва. Ур-ние (1) с учетом разветвления
цепи записывается в виде:
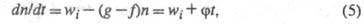
где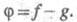 До тех пор пока g > f, будет наблюдаться Ц. р., кинетика
к-рой не отличается от неразветвленных Ц.р. С ростом f в соответствии
с (2) п будет нарастать до все более высоких стационарных значений:
До тех пор пока g > f, будет наблюдаться Ц. р., кинетика
к-рой не отличается от неразветвленных Ц.р. С ростом f в соответствии
с (2) п будет нарастать до все более высоких стационарных значений:
п = wi /(g -f).
Если же f станет больше
g, т.
е.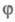 станет
положит. величиной, решением ур-ния (5) будет выражение:
станет
положит. величиной, решением ур-ния (5) будет выражение:
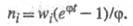
Выражение для скорости Ц.р., известное как ур-ние Семенова, имеет вид:
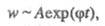
т. е. концентрация активных частиц не принимает
стационарного значения, а непрерывно нарастает, как и пропорциональная
ей скорость Ц. р., переходящей в самовоспламенение. Условие g = f ,
или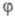 =0
- граничное для перехода от стационарного режима разветвленно-цепного процесса
к нестационарному, протекающему с самоускорением (рис. 1). Чем быстрее
р-ция, чем больше концентрация активных частиц, тем сильнее ускоряется
р-ция. Т. обр., для разветвленных Ц. р. реализуется положит. oбратная связь.
=0
- граничное для перехода от стационарного режима разветвленно-цепного процесса
к нестационарному, протекающему с самоускорением (рис. 1). Чем быстрее
р-ция, чем больше концентрация активных частиц, тем сильнее ускоряется
р-ция. Т. обр., для разветвленных Ц. р. реализуется положит. oбратная связь.
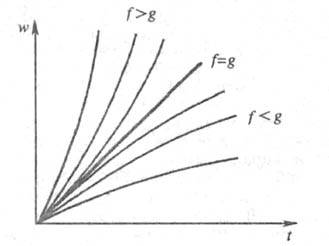
Рис. 1. Динамика разветвленного
цепного процесса при различных соотношениях факторов обрыва и разветвления
цепи (соотв. g и f,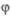 =f
-
g); w - скорость цепной р-ции, t - время.
=f
-
g); w - скорость цепной р-ции, t - время.
Переход от стационарного к нестационарному
протеканию Ц. р. может происходить как при увеличении
f, так и при
уменьшении g. Очевидно, что чем ближе условия к граничному f
= g, тем меньшие изменения f или g
могут привести
к срыву и переходу р-ции в режим самоускорения.
Наиб. детально изучено разветвление-цепное
окисление Н2 в смеси с О2. Р-ция инициирования продолжение цепи определяется р-циями:
продолжение цепи определяется р-циями:
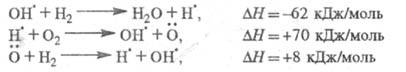
Суммарная р-ция:
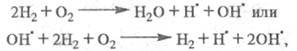
т. е. в ЦПЦ не только образуется продукт
Н2О и регенерируются переносчики цепи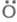 ,
но и возникают еще два переносчика цепи
,
но и возникают еще два переносчика цепи и
и Каждый
из переносчиков цепи может либо погибнуть в р-циях обрыва, либо начать
новое звено цепи, с образованием еще большего числа переносчиков цепи.
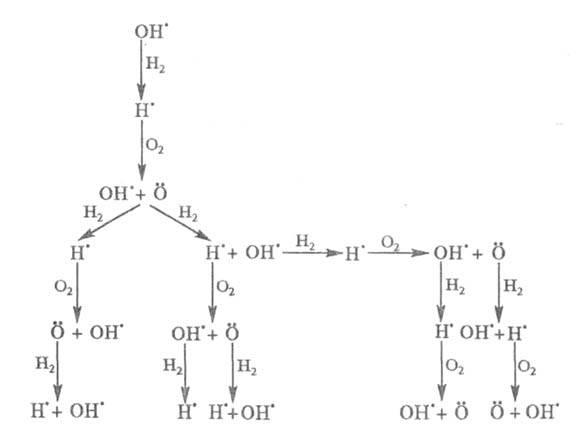
Приведенная ниже схема развития цепного процесса в условиях, когда f
>
g, наглядно иллюстрирует явление разветвления цепи:
Каждый
из переносчиков цепи может либо погибнуть в р-циях обрыва, либо начать
новое звено цепи, с образованием еще большего числа переносчиков цепи.
Приведенная ниже схема развития цепного процесса в условиях, когда f
>
g, наглядно иллюстрирует явление разветвления цепи:
Все известные разветвленно-цепные р-ции
являются экзотермическими, причем часть выделяемой энергии переходит в
энергию активных частиц. Поэтому для разветвления цепи необходимо, чтобы
тепловой эффект брутто-процесса значительно превосходил тепловой эффект
наиб. энергоемкой из всех стадий разветвления (для окисления Н2
это соотв. 483 и 70 кДж/моль).
К изученным разветвленно-цепным р-циям
относятся окисление паров Р, S; р-ции О2 с CS2, CO,
SiH4, углеводородами; разложение NC13. Для всех этих
р-ций характерно наличие нижнего и верхнего пределов самовоспламенения.
Их происхождение определяется переходами через граничное условие f =
g.
В случае газофазных р-ций при низком давлении р диффузия переносчиков
цепи к стенке и их гибель обусловливает неравенство g >
f и
р-ция практически не наблюдается. Рост давления препятствует диффузии,
при этом g уменьшается, а f растет, т. к. обычно в р-ции
разветвления участвует один из реагентов, давление к-рого составляет часть
общего давления. При переходе через граничное условие f =
g происходит
самоускорение р-ции и самовоспламенение смеси. Граничному условию соответствует
нек-рое значение р1 -давление нижнего предела
самовоспламенения. Соотношение f > g соблюдается при р>р1,
но при дальнейшем росте р способность смеси к самовоспламенению
исчезает. С ростом р растет доля тримолекулярных соударений, в результате
к-рых происходит гибель переносчиков цепи в газовой фазе. Это м. б. также
столкновения двух активных частиц с любой третьей частицей М и переход
активной частицы в малоактивную, не участвующую в р-циях продолжения и
разветвления цепи. Так, в смеси Н2 с О2 возможна
гибель по
р-ции
по
р-ции с послед. гибелью
с послед. гибелью в р-циях друг с другом или с переносчиками цепи
в р-циях друг с другом или с переносчиками цепи и
и За
счет тримолекулярных р-ций фактор g, пропорциональный р2,
опережает в своем росте фактор f, пропорциональный р. В результате
при нек-ром р2 - давлении верхнего предела -вновь происходит
переход через граничное условие f = g и смесь теряет способность
к самовоспламенению. Явление верхнего предела было открыто и объяснено
С. Хиншелвудом (1956). Семенову и Хиншелвуду за исследование механизма
хим. р-ций была присуждена Нобелевская премия.
За
счет тримолекулярных р-ций фактор g, пропорциональный р2,
опережает в своем росте фактор f, пропорциональный р. В результате
при нек-ром р2 - давлении верхнего предела -вновь происходит
переход через граничное условие f = g и смесь теряет способность
к самовоспламенению. Явление верхнего предела было открыто и объяснено
С. Хиншелвудом (1956). Семенову и Хиншелвуду за исследование механизма
хим. р-ций была присуждена Нобелевская премия.
С ростом т-ры Т область воспламенения
- разность между р2 и р1
- расширяется, т. к. фактор f, характеризующий энергоемкую р-цию
разветвления, возрастает с ростом Т значительно, а фактор g от
Т
зависит слабо. В случае понижения Т и р2при
нек-рой Т значения pl и р2становятся
одинаковыми. Зависимости pl и р2
от T образуют характерный полуостров воспламенения (рис. 2). Контур
этого полуострова может изменяться при изменении условий опыта. Так, при
увеличении отношения S/V, напр. введением в сосуд стержней, g
возрастает
и происходит повышение нижнего предела р1как ф-ции Т.
Тот же эффект проявляется при уменьшении диаметра сосуда, т. е. увеличении
S/V. Разбавление смеси инертным газом затрудняет диффузию активных
частиц к стенке и одновременно повышает долю тримолекулярных столкновений
из-за роста общего давления. В результате происходят уменьшение g в
области нижнего предела самовоспламенения и рост g в области верхнего
предела. При введении ингибитора контур полуострова воспламенения изменяется,
нижний предел повышается, верхний - понижается.
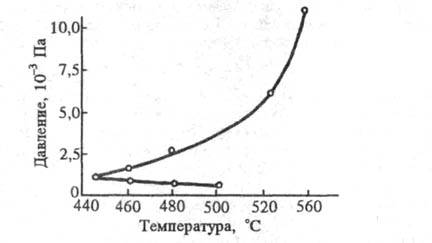
Рис. 2. Полуостров воспламенения смеси водорода с кислородом.
Самоускорение Ц. р. с разветвлением цепей,
описываемое ур-нием Семенова, обусловлено переходом энергии экзотермич.
р-ции в хим. энергию активных частиц. Так, в определенных условиях до половины
кол-ва молекул Н2 в режиме самовоспламенения может существовать
в форме атомов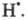 Другая возможность - переход энергии экзотермич. хим. р-ции в кинетич.
энергию частиц и рост т-ры в случае, если скорость разогревания смеси превышает
скорость отвода тепла от сосуда. Повышение т-ры приводит к ускорению р-ции,
повышению интенсивности тепловыделения и дальнейшему росту т-ры и скорости
р-ции - тепловому взрыву. В основе такого процесса м. б. как неразветвленная
Ц. р., так и р-ция с разветвлением цепей. В последнем случае появляется
т. наз. третий предел самовоспламенения: смесь, потерявшая способность
к самовоспламенению при р>р2, с послед. повышением
р
вновь становится самовоспламеняющейся.
Другая возможность - переход энергии экзотермич. хим. р-ции в кинетич.
энергию частиц и рост т-ры в случае, если скорость разогревания смеси превышает
скорость отвода тепла от сосуда. Повышение т-ры приводит к ускорению р-ции,
повышению интенсивности тепловыделения и дальнейшему росту т-ры и скорости
р-ции - тепловому взрыву. В основе такого процесса м. б. как неразветвленная
Ц. р., так и р-ция с разветвлением цепей. В последнем случае появляется
т. наз. третий предел самовоспламенения: смесь, потерявшая способность
к самовоспламенению при р>р2, с послед. повышением
р
вновь становится самовоспламеняющейся.
Энергетическое разветвление цепей. Возможен
переход энергии хим. р-ции в энергию возбуждения внутр. степеней свободы
частиц, образующихся в экзотермич. элементарной стадии; в этом случае нарушается
равновесное распределение частиц по энергиям. Сверхравновесная концентрация
вращательно-возбужденных состояний быстро, в результате неск. соударений,
уменьшается до равновесной. Для диссипации избыточной колебат. энергии
необходимо участие возбужденной частицы в тысячах соударений, т. е. время
жизни колебательно-возбужденных состояний много больше, чем вращательно-возбужденных.
Это может привести к росту скорости р-ции, т. к. константы скорости с участием
колебательно-возбужденных частиц м. б. на много порядков больше, чем для
невозбужденных.
Впервые роль колебательно-возбужденных
состояний в самоускорении разветвленно-цепных р-ций была выявлена для высокоэкзотермич.
р-ции
Н2 + F2 2HF;
2HF;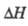 =
-537 кДж/моль
=
-537 кДж/моль
Аналогичная р-ция Н2 + С12 2НС1
протекает как неразветвленный процесс. В отсутствие светового воздействия
для обеих р-ций инициирование происходит на стенке сосуда: (Х2
+ S
2НС1
протекает как неразветвленный процесс. В отсутствие светового воздействия
для обеих р-ций инициирование происходит на стенке сосуда: (Х2
+ S X2S
X2S SX +
SX +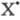 )
и в объеме (Х2 + М
)
и в объеме (Х2 + М М + 2Х), где X - С1 или F. Большая разница энергий связи F — F (159 кДж/моль)
и Н — F (565 кДж/моль) определяет еще один канал образования атомарного
F:
М + 2Х), где X - С1 или F. Большая разница энергий связи F — F (159 кДж/моль)
и Н — F (565 кДж/моль) определяет еще один канал образования атомарного
F:

Для аналогичной р-ции с участием С12
необходимо затратить 248 кДж/моль, т. е. такая р-ция практически не происходит.
Р-ции продолжения цепи для обеих систем подобны:
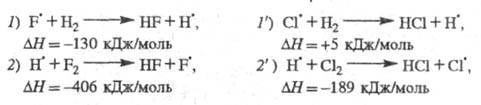
Энергия, выделяющаяся в р-циях 7,2 и 2',
частично переходит в энергию колебат. возбуждения продуктов - соотв. HF
и НС1. При последующих соударениях избыточная колебат. энергия рассеивается
- переходит в поступат. и вращат. энергию мн. других частиц.
Имеются, однако, две возможности перехода
колебат. энергии в хим. энергию активных частиц. Если энергия возбуждения
конечного или промежут. продукта достаточна для его распада на активные
частицы, может пойти р-ция размножения частиц. В рассматриваемых р-циях
такая возможность отсутствует, т. к. соответствующие энергии связи составляют
565 (для Н — F) и 431 кДж/моль (для Н — С1), т. е. они больше, чем тепловые
эффекты р-ций соотв. 2 и 2'.
Вторая возможность - передача энергии
колебат. возбуждения продукта на частицу реагента. Такая передача тем вероятней,
чем ближе значения энергий колебат. возбуждения сталкивающихся частиц.
Для рассматриваемых частиц колебат. кванты таковы (в кДж/моль):
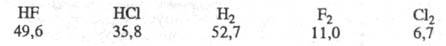
Энергии колебат. возбуждения близки лишь
для пары HF-H2. Между этими частицами может протекать реакция (значок v означает колебат. возбуждение). Частица
(значок v означает колебат. возбуждение). Частица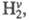 как и Н2, реагирует с F2, но для р-ции
как и Н2, реагирует с F2, но для р-ции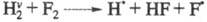 тепловой эффект составляет не +30, а -22,7 кДж/моль, а ее константа скорости
примерно в 107 больше, чем для р-ции невозбужденного Н2.
Дополнив р-ции 7 и 2 рассмотренными р-циями колебательно-возбужденных частиц,
получаем след. ЦПЦ:
тепловой эффект составляет не +30, а -22,7 кДж/моль, а ее константа скорости
примерно в 107 больше, чем для р-ции невозбужденного Н2.
Дополнив р-ции 7 и 2 рассмотренными р-циями колебательно-возбужденных частиц,
получаем след. ЦПЦ:
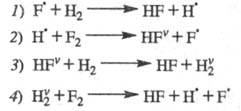
Сумарная р-ция:
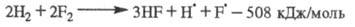
Все особенности разветвленно-цепных р-ций
- существование нижнего и верхнего предельных давлений, наличие полуострова
воспламенения, зависимость положения нижнего предела от размеров сосуда
и т. п.- присущи и этой р-ции с энергетич. разветвлением цепи.
Энергетич. разветвление цепей было открыто
в 1963 Семеновым. Впоследствии было обнаружено энергетич. разветвление
цепей без передачи энергии колебат. возбуждения. Так, для р-ции CH2F2
+ 2F2 CF4 + 2HF был установлен механизм разветвления цепей в результате
распада промежут. в-ва, образующегося в состоянии колебат. возбуждения:
CF4 + 2HF был установлен механизм разветвления цепей в результате
распада промежут. в-ва, образующегося в состоянии колебат. возбуждения:
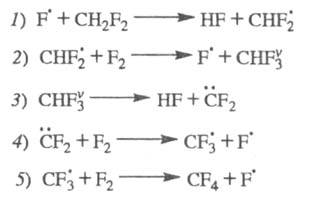
Суммарная р-ция:

По механизму Ц. р. с энергетич. разветвлением
происходят газофазное фторирование СН4 и его галогенпроизводных,
фторирование этана, окисление тетрафторэтилена и ряда хлорзамещенных олефинов,
хлорирование силана и нек-рые др. процессы. Поскольку в Ц. р. с энергетич.
разветвлением возникает инверсная заселенность колебат. уровней, такие
Ц. р. представляют практич. интерес для решения проблемы создания лазеров
с хим. накачкой (см. Лазеры химические).
Разветвленно-цепные р-ции могут протекать
стационарно, если g > f, и с самоускорением, если f >
g. Значения =f
- g таковы, что вся р-ция протекает за доли секунды.
=f
- g таковы, что вся р-ция протекает за доли секунды.
Р-ции с вырожденным разветвлением.
Такое
назв. получили многочисленные радикально-цепные р-ции, для к-рых характерно
самоускорение, описываемое ур-нием Семенова с очень малыми значениями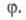 Для таких р-ций обычно не наблюдается перехода в режим самовоспламенения
или взрыва. По достижении нек-рой макс. скорости такие р-ции замедляются
(рис. 3). С этим связано второе назв. таких р-ций - вырожденный цепной
взрыв. Характерное время их ускоренного протекания - не доли секунды, а
десятки минут и часов. Различие величин j
определяет различие механизмов.
Для таких р-ций обычно не наблюдается перехода в режим самовоспламенения
или взрыва. По достижении нек-рой макс. скорости такие р-ции замедляются
(рис. 3). С этим связано второе назв. таких р-ций - вырожденный цепной
взрыв. Характерное время их ускоренного протекания - не доли секунды, а
десятки минут и часов. Различие величин j
определяет различие механизмов.
Рис. 3. Динамика процессов с вырожденным разветвлением цепей (1) и разветвленного цепного (2). Заштрихованные площади отражают кол-во реагентов, прореагировавших к моменту времени t.
Рассмотрим, напр., цепное окисление углеводородов. В этом случае ЦПЦ включает след. р-ции:
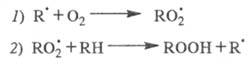
В отсутствие инициатора инициирование происходит по р-ции:
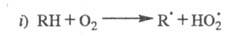
Радикалы не участвуют в ЦПЦ и исчезают в разл. р-циях гибели на стенке и в объеме.
Концентрации частиц
не участвуют в ЦПЦ и исчезают в разл. р-циях гибели на стенке и в объеме.
Концентрации частиц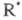 и
и за
доли секунды достигают своего стационарного значения, определяемого ур-нием
(2), a ROOH накапливается в системе и служит инициатором:
за
доли секунды достигают своего стационарного значения, определяемого ур-нием
(2), a ROOH накапливается в системе и служит инициатором:

Последующее быстрое образование переносчика
цепи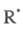 происходит в результате р-ций:
происходит в результате р-ций:
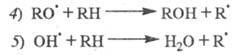
Т. обр., по мере протекания р-ции и накопления ROOH скорость инициирования растет:
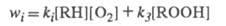
Чем больше wi, тем больше скорость образования ROOH, a чем больше [ROOH], тем сильнее ускоряется инициирование. Так реализуется положит. обратная связь в случае р-ций с вырожденным разветвлением цепей. Суммарная р-ция:
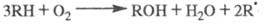
Это ур-ние ничем не отличается от аналогичного
для разветвленно-цепных р-ций, и если бы распад ROOH на и
и происходил
с характерным временем, соизмеримым со временем развития звена цепи, не
было бы отличия в их поведении. В действительности же эти времена сильно
разнятся. Одна р-ция разветвления 3 приходится на многие тысячи
р-ций 1 и 2, составляющих ЦПЦ неразветвленного окисления
RH. Рост [ROOH] в ходе р-ции мог бы тем не менее привести к тому, что величины
k3[ROOH] и
происходил
с характерным временем, соизмеримым со временем развития звена цепи, не
было бы отличия в их поведении. В действительности же эти времена сильно
разнятся. Одна р-ция разветвления 3 приходится на многие тысячи
р-ций 1 и 2, составляющих ЦПЦ неразветвленного окисления
RH. Рост [ROOH] в ходе р-ции мог бы тем не менее привести к тому, что величины
k3[ROOH] и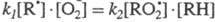 стали бы соизмеримы. Этого не происходит из-за того, что ROOH - нестабильный
промежут. продукт, и со скоростью, намного большей, чем для р-ции 5, происходит
превращение ROOH в стабильные продукты окисления RH - кетоны, к-ты и др.
по р-ции:
стали бы соизмеримы. Этого не происходит из-за того, что ROOH - нестабильный
промежут. продукт, и со скоростью, намного большей, чем для р-ции 5, происходит
превращение ROOH в стабильные продукты окисления RH - кетоны, к-ты и др.
по р-ции:

Поскольку не происходит значит, накапливания ROOH, а по мере его накапливания расход
RH по р-циям 1, 2 и 6 оказывается столь большим, что скорость всех
р-ций с участием RH падает значительно. Рассмотренными факторами и определяются
характерные особенности вырожденно-разветвленных Ц. р.: рост скорости на
начальных стадиях, описываемый ур-нием
не происходит значит, накапливания ROOH, а по мере его накапливания расход
RH по р-циям 1, 2 и 6 оказывается столь большим, что скорость всех
р-ций с участием RH падает значительно. Рассмотренными факторами и определяются
характерные особенности вырожденно-разветвленных Ц. р.: рост скорости на
начальных стадиях, описываемый ур-нием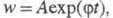 но с очень малым
но с очень малым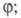 уменьшение скорости р-ции на более поздних стадиях р-ции. К р-циям с вырожденным
разветвлением относятся многочисленные р-ции окисления не только углеводородов,
но и большинства др. орг. соединений, поскольку их общим св-вом является
промежут. образование ROOH. Подобным образом протекает и окисление сероводорода.
уменьшение скорости р-ции на более поздних стадиях р-ции. К р-циям с вырожденным
разветвлением относятся многочисленные р-ции окисления не только углеводородов,
но и большинства др. орг. соединений, поскольку их общим св-вом является
промежут. образование ROOH. Подобным образом протекает и окисление сероводорода.
Большой вклад в изучение этих р-ций был
сделан А. Б. Налбандяном и Н. М. Эмануэлем. Большое значение имело открытие
разветвленных и вырожденно-разветвленных Ц. р. для создания теории горения.
Р-ции с вырожденным разветвлением цепей
при повышенных т-рах могут протекать как разветвленно-цепные. Так, H2S
реагирует с О2 при 250-300 °С по механизму вырожденного разветвления
цепей, а при 350-400 °С наблюдаются нижний и верхний пределы самовоспламенения.
По-видимому, при повышенных т-рах становятся существенными р-ции разветвления,
к-рые не идут при низких т-рах. Для окисления углеводородов Семенов рассмотрел
возможность разветвления в результате высокотемпературного распада на
на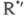 и альдегид R"CHO и последующей р-ции
и альдегид R"CHO и последующей р-ции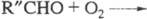
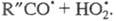
Образование ответственного за разветвление
промежут. продукта в результате протекания неразветвленно-цепной р-ции
и возможность перехода р-ций с вырожденным разветвлением в разветвленно-цепные
свидетельствует о том, что механизм вырожденного разветвления цепей занимает
промежут. положение между неразветвленным и разветвленно-цепным механизмами.
Лит.: Семёнов Н. Н., Развитие теории цепных реакций и теплового воспламенения, М., 1969; Проблемы химической кинетики, М., 1979; Налбандян А. Б., Варданян И. А., Современное состояние проблемы газофазного окисления органических соединений, Ер., 1986.
А. П. Пурмаль.

