Нептуний
НЕПТУНИЙ (от назв.
планеты Нептун; лат. Neptunium) Np, искусственный радиоактивный хим. элемент
III гр. перио-дич. системы, ат. н. 93, относится к актиноидам. Стабильных
изотопов не имеет. Известно 15 изотопов с маc. ч. 227-241. Наиб. долгоживущий
изотоп-237Nр (Т1/2 2,14.106
лет, a-излучатель), являющийся родоначальником четвертого радиоактивного ряда.
В природе встречается в ничтожных кол-вах в урановых рудах. Образуется из ядер
урана под действием нейтронов космич. излучения и нейтронов спонтанного деления
238U. Конфигурация внеш. электронных оболочек атома 5f46s26p66d17s2;
степени окисления +3, +4, + 5 (наиб. устойчива), +6, +7; электроотрицательность
по Полингу 1,22; ат. радиус 0,155 нм, ионные радиусы Np3+ 0.0986
нм, Np4+ 0,0913 нм, Np5+ 0,087 нм, Np6+ 0,082
нм.
Свойства. Н.-хрупкий
серебристо-белый металл. Известен в трех полиморфных модификациях: ниже 280
°С устойчива a-форма с орторомбич. решеткой (а = 0,472 нм, b =
0,488 нм, с = 0,666 нм, пространств. группа Pmcn); в интервале
280-576 °С устойчива р-форма с тетрагон. решеткой (а = 0,489 нм,
с = 0,338 нм); выше 576 °С существует модификация с кубич. гранецентрированной
решеткой (а = 0,343 нм). Для Н. т. пл. 639 °С, т. кип. 4082 °С;
рентгеновская плотн. 20,45 г/см3; С0р
29,62 Дж/(моль.К); DH0возг 561 кДж/моль;
S0298 50,45 Дж/(моль.К); ур-ние
температурной зависимости давления пара металлич. Н. в интервале 1700-1950 К:
lgp(мм рт.ст.) = -22370/T + 5,196; металлич. Н. парамагнитен.
Н. весьма реакционноспособен,
раств. в разб. НСl с образованием ионов Np3+ в присут. восстановителей
или Np4+ в присут. воздуха. При нагр. Н. в атмосфере Н2 образуются
гидриды перем. состава NpH2+x (х = 0-0,7), а также
NpH3- черные кристаллы с металлич. блеском (а
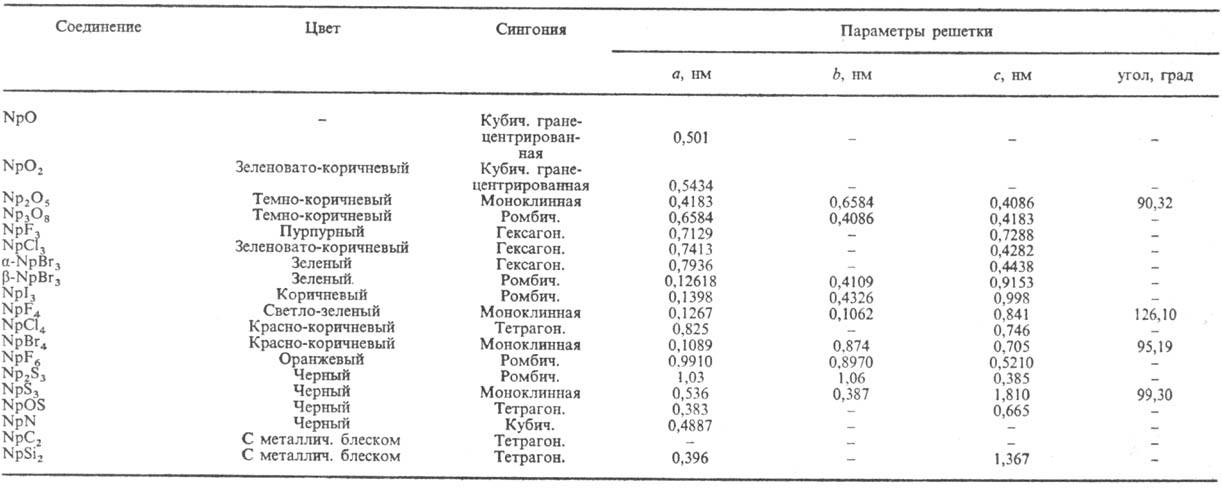
= 0,3771 нм, с = 0,6713 нм). Св-ва нек-рых соед. Н. приведены в таблице.
Д и о к с и д NpO2
получают прокаливанием гидроксида, нитрата, оксалата, ацетата, пероксида и др.
соед. Н. в любой степени окисления при 600-800 °С, окислением Н. на воздухе
при 800-1000 °С или восстановлением высших оксидов Н. оксидом углерода.
Оксид Np3O8 получают нагреванием гидроксида NpO2OH.xH2O
в токе О2 при 300-450 °С. Оксиды Н. в твердом состоянии реагируют
с оксидами щелочных и щел.-зем. металлов, образуя нептунаты (IV, V, VI, VII),
напр. Na2NpO4, Li5NpO6.
Т р и ф т о р и д NpF3
и трихлорид NpCl3 синтезируют взаимод. NpO2 соотв. с эквимолярной
смесью Н2 с HF (при 500 °C и Н2 с ССl4
при 350 °С; т р и б р о м и д NpBr3 и т р и и о д и д NpI3-p-цией
NpO2 с избытком смеси Аl соотв. с АlВr3 при 350-400 °С
или АlI3 при 500 °С. Нагреванием NpO2 в токе HF при
500 °С, ССl4 при 450-530 °С или взаимод. NpO2
с АlВr3 при 350 °С получают соответствующие тетрагалогениды NpX4
(X = F, Cl, Вr). Т е т р а ф т о р и д NpF4 плохо раств. в воде и
орг. р-рителях; при 500 °С восстанавливается Н2 до NpF3,
с F2 выше 250 °С образует г е к с а ф т о р и д NpF6
(в парообразном состоянии бесцветный). Для NpF6 т.пл. 55 °С,
т. кип. 55,18°С; давление пара 27 кПа (273 К), 167 кПа (298 К); на свету
разлагается; бурно реагирует с водой.
Синтезированы оксогалогениды
Н.: оксодихлорид NpOCl2-желто-оранжевые кристаллы с орторомбич. решеткой
(а = 1,5209 нм, b = 1,7670 нм, с = 0,3948 нм); оксодибромид
NpOBr2 получают при взаимод. Sb2O3 с NpBr4
при 150°С; диоксофторид NpO2F-кристаллы с тетрагон. решеткой
(а = 0,8341 нм, с = 0,7193 нм); оксотрифторид NpOF3-кристаллы
с ромбоэдрич. решеткой (а = 0,4185 нм, с = = 1,5799 нм), образуется
при взаимод. Np2O5 с безводным HF при 50-60 °С; диоксодифторид
NpO2F2-кристаллы с гексагoн. решеткой (а = 0,4185
нм, с = 1,5790 нм), получают взаимод. NpO3•Н2О
с жидким BrF3 при комнатной т-ре, с HF при 300 °С или F2
при 230 °С. Известны фторонептуна-ты: Li[NpF5], M2[NpF6],
где М = Na, К, Rb; M[NpF6], где М = Са, Ва, Pb(II); M7[Np6F31],
где М = Na, К, Rb; Na3[NpF8]- сиреневые кристаллы с тетрагон.
решеткой (а = 0,5410 нм, с = 1,089 нм); Pb[NpF7]-розово-фиолетовые
кристаллы с моноклинной решеткой (а = 0,626 нм, b = 1,342 нм,
с = 0,890 нм); Cs[NpF6]-розово-фиолетовые кристаллы с ромбоэдрич.
решеткой (а = 0,8017 нм, с = = 0,8386 нм); Rb[NpO2F2]
и Cs[NpO2F3] кристаллизуются при испарении конц. р-ра
HF, содержащего эквимолярные кол-ва CsF и NpO3.H2O.
Известны хлоронептунаты(IV) M2[NPCl6], где
М = Cs, (CH3)4N+, (C2H5)4N+,
оксихлоро-нептунаты(V, VI).
С е с к в и с у л ь ф и
д Np2S3 синтезирован при 1000°С взаимод. NpO2
со смесью H2S и CS2, нитрид NpN-p-цией гидрида Н. с безводным
NH3 при 750-770 °С, дисилицид NpSi2-нагреванием Si
и NpF3 при 1500°С в вакууме.
В водных р-рах Н. может существовать в степенях окисления от +3 до +7. Стандартные окислит. потенциалы для Np(IV)/Np(III) 0,155 В, Np(V)/Np(IV) 0,739 В, Np(VI)/Np(V) 1,137 В, Np(VII)/Np(VI) 2,04 В, Np(V)/Np(III) 0,477 В, Np(VI)/Np(III) 0,677 В, Np(VI)/Np(IV) 0,938 В. Для бесконечно разб. водных р-ров DH0обр (кДж/моль) ионов: —527,13 (Np3+), - 556,00 (Np4+), - 978,12 (NpO2+), -860,56 (NpO22+). При окислении Np(VI) озоном в щелочной среде образуется Np(VII). Ионы Н. в р-ре склонны к гидролизу и комплексо-образованию. В слабокислых р-рах существуют ионы [Np(H2O)8]3+, [NpO2(H2O)6]4+ и [NpO2(H2O)6]2+. Ионы Н. в р-рах имеют характерную окраску: Np3+ -фиолетово-голубую, Np4+-желто-зеленую, NpO+2-зелено-голубую, NpO22+-розовую и NpO23+ -зеленую в щелочных р-рах и коричневую в р-ре НСlО4. По способности к комплек-сообразованию ионы Н. располагаются в ряд: Np4+ > > NpO22+ > Np3+ > NpO2+ > NpO23+ . Ионы Н. склонны к диспропорционированию в зависимости от кислотности и состава среды, на их хим. поведение в целом влияют продукты радиолиза р-ров, образующиеся под действием собств. излучения Н.
ХАРАКТЕРИСТИКА СОЕДИНЕНИЙ
НЕПТУНИЯ
Получение. Изотопы
Н. образуются при длит. облучении U в ядерных реакторах и выделяются как побочные
продукты при получении плутония. Изотоп 237Np получается по р-ции
238U (п, 2n) 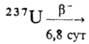 237Np
в кол-вах, составляющих ~0,3%
от образовавшегося Рu или 10-6-10-4% по массе от содержания
U. В реакторах, работающих на U, обогащенном 235U, изотоп 237Np
образуется гл. обр. по р-ции 235U(n,
g)236U(n, g)
237Np
в кол-вах, составляющих ~0,3%
от образовавшегося Рu или 10-6-10-4% по массе от содержания
U. В реакторах, работающих на U, обогащенном 235U, изотоп 237Np
образуется гл. обр. по р-ции 235U(n,
g)236U(n, g)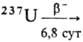 237Np. Осн. сырьевой источник 237Np-высокорадиоактивные
отходы плутониевого произ-ва, получаемые при переработке U, облученного в ядерных
реакторах. Мировое произ-во Н. (без СССР; 1990) 0,5-1 т/год. 237Np
высокой изотопной чистоты выделяют также из препаратов 241Ат
как продукт его а-распада. Короткоживущий изотоп 239Np (T1/2
56,5 ч)-промежут. продукт в произ-ве Рu, а также дочерний продукт распада 243Ат.
Легкие (нейтронодефицитные) изотопы Н. обычно получают при облучении изотопов
U в ядерных р-циях дейтронами разл. энергии. Выделяют изотопы Н. осаждением,
ионным обменом, экстракцией и экстракционно-хро-матографически. Металлич. Н.
получают восстановлением NpF4 парами Ва или Са при т-ре выше 700
°С.
237Np. Осн. сырьевой источник 237Np-высокорадиоактивные
отходы плутониевого произ-ва, получаемые при переработке U, облученного в ядерных
реакторах. Мировое произ-во Н. (без СССР; 1990) 0,5-1 т/год. 237Np
высокой изотопной чистоты выделяют также из препаратов 241Ат
как продукт его а-распада. Короткоживущий изотоп 239Np (T1/2
56,5 ч)-промежут. продукт в произ-ве Рu, а также дочерний продукт распада 243Ат.
Легкие (нейтронодефицитные) изотопы Н. обычно получают при облучении изотопов
U в ядерных р-циях дейтронами разл. энергии. Выделяют изотопы Н. осаждением,
ионным обменом, экстракцией и экстракционно-хро-матографически. Металлич. Н.
получают восстановлением NpF4 парами Ва или Са при т-ре выше 700
°С.
Определение. Аналит.
определению Н. обычно предшествует его концентрирование, выделение и очистка.
Чаще всего для количеств. определения Н. используют радио-метрич. и спектрофотометрич.
методы. Уд. a-активность 237Np составляет 1540 a-частиц/(мкг•мин).
Определение 239Np и 238Np проводят изменением b-активности
(чувствительность 37 Бк) или g-излучения (чувствительность 3,7.104
Бк) с энергией соотв. 100 и 1000 кэВ. Чувствительность радиоактивационного определения
237Np (по g-линии 238Np) 10-3 мкг. Спектрофотометрич.
определение Н. проводят по линии поглощения Np5+ при l = 983 нм,
метод позволяет определять 100-200 мкг Н. с ошибкой 2%. Большей чувствительностью
(~2 мкг Н.) обладают методы, основанные на р-циях с орг. реагентами. Для определения
субмикрограммовых кол-в Н. начиная с 80-х гг. используют люминесцентные методы.
Для высокоточного определения Н. (b0,1%) после его выделения и концентрирования
используют электрохим. методы (полярография, амперо-метрич., потенциомeтрич.
и кулонометрич. титрование).
Изотоп 237Np
применяют в качестве стартового материала для произ-ва 238Рu.
Н. высоко токсичен: ПДК
237Np в открытых водоемах и воздухе
рабочих помещений соотв. 55,5 и 2,6.10-6 Бк/л. Впервые
Н. получен Э. Макмилланом и Ф. Эйблсоном в 1940.
Лит.: Schulz W.
W., Benedict G. E., Neptunium-237. Production and recovery, [Wash.], 1972. См.
также лит. при ст. Актиноиды. Б. Ф. Мясоедов.

