Испарение
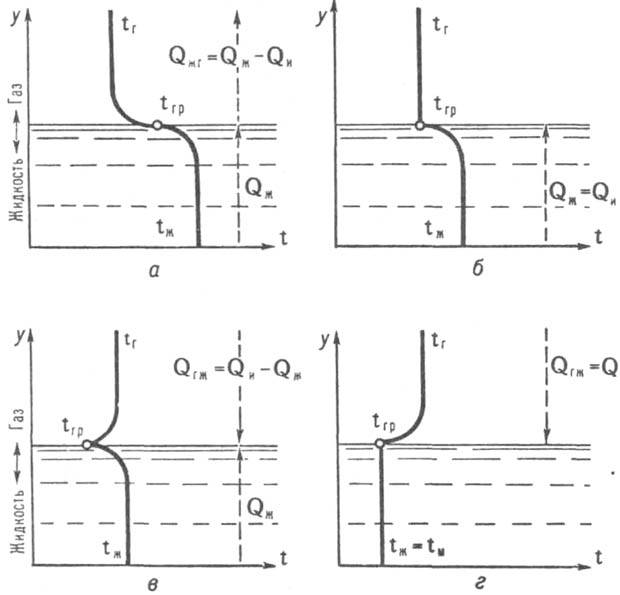
Рис. Распределение т-р при разл. режимах испарительного охлаждения жидкости. Потоки теплоты направлены: а - от жидкой фазы к пов-сти испарения в газовую фазу; б - от жидкой фазы только к пов-сти испарения; в - к пов-сти испарения со стороны обеих фаз; г - к пов-сти испарения только со стороны газовой фазы.
Эффекты баро- и термодиффузии при инженерных расчетах обычно не учитываются, но влияние термодиффузии м. б. существенным при высокой неоднородности парогазовой смеси (при большом различии мол. масс ее компонентов) и значит. градиентах т-р. При движении одной или обеих фаз относительно пов-сти их раздела возрастает роль конвективного переноса в-ва и энергии в парогазовой смеси и жидкости. При отсутствии подвода энергии к системе жидкость-газ от внеш. источников теплота И. может подводиться к поверхностному слою жидкости со стороны одной или обеих фаз. В отличие от результирующего потока в-ва, всегда направленного при И. от жидкости в газовую среду, потоки теплоты могут иметь разные направления в зависимости от соотношений т-р осн. массы жидкости tж, границы раздела фаз tгр и газовой среды tг (см. рис.). При контакте определенного кол-ва жидкости с полубесконечным объемом или омывающим ее пов-сть потоком газовой среды и при т-ре жидкости, более высокой, чем т-ра газа (tж > tгр > tг), возникает поток теплоты со стороны жидкости к пов-сти раздела фаз: (Qжг = Qж — Qи, где Qи -теплота И., Qжг - кол-во теплоты, передаваемой от жидкости газовой среде. При этом жидкость охлаждается (т. наз. испарительное охлаждение). Если в результате такого охлаждения достигается равенство tгр = tг, теплоотдача от жидкости к газу прекращается (Qжг = 0) и вся теплота, подводимая со стороны жидкости к пов-сти раздела, затрачивается на И. (Qж = Qи). В случае газовой среды, не насыщенной паром, парциальное давление последнего у пов-сти раздела фаз и при Qж = Qи остается более высоким, чем в осн. массе газа, вследствие чего И. и испарительное охлаждение жидкости не прекращаются и tгр становится ниже tж и tг. При этом теплота подводится к пов-сти раздела от обеих фаз до тех пор, пока в результате понижения tж достигается равенство tгр = tж и поток теплоты со стороны жидкости прекращается, а со стороны газовой среды Qгж становится равным Qи. Дальнейшее И. жидкости происходит при постоянной т-ре tм = tж = tгр, к-рую наз. пределом охлаждения жидкости при испарительном охлаждении или т-рой мокрого термометра (т.к. ее показывает мокрый термометр психрометра). Значение tм зависит от параметров парогазовой среды и условий тепло- и массообмена между жидкой и газовой фазами. Если жидкость и газовая среда, имеющие разл. т-ры, находятся в ограниченном объеме, не получающем энергию извне и не отдающем ее наружу, И. происходит до тех пор, пока между двумя фазами не наступает термодинамич. равновесие, при к-ром т-ры обеих фаз уравниваются при неизменной энтальпии системы, и газовая фаза насыщается паром при т-ре системы tад. Последняя, наз. температурой адиабатич. насыщения газа, определяется только начальными параметрами обеих фаз и не зависит от условий тепло- и массообмена. Скорость изотермич. И. [в кг/(м2.с)] при однонаправленной диффузии пара в расположенный над пов-стью жидкости неподвижный слой бинарной парогазовой смеси толщиной d (в м) м. б. найдена по ф-ле Стефана: jп = (D/RпT)(p/d) ln [(p - рп,гр)/(р — рп)]-1 , где D - коэф. взаимной диффузии, м2/с; Rп - газовая постоянная пара, Дж/кг (кг.К) или м2/(с2.к); T - т-ра смеси, К; р - давление парогазовой смеси, Па; рп,гр, рп - парциальные давления пара у пов-сти раздела и на наружной границе слоя смеси, Па. В общем случае (движущиеся жидкость и газ, неизотермич. условия) в прилегающем к пов-сти раздела фаз пограничном слое жидкости переносу импульса сопутствует перенос теплоты, а в пограничном слое газа (парогазовой смеси) происходят взаимосвязанные тепло- и массоперенос. При этом для расчета скорости И. используют эксперим. коэффициенты тепло- и массоотдачи, а в относительно более простых случаях - приближенные методы численных решений системы дифференц. ур-ний для сопряженных пограничных слоев газовой и жидкой фаз. Интенсивность массообмена при И. зависит от разности хим. потенциалов пара у пов-сти раздела и в осн. массе парогазовой смеси. Однако если баро- и термодиффузией можно пренебречь, разность хим. потенциалов заменяют разностью парциальных давлений или концентраций пара и принимают: jп = bp (рп,гр - рп,осн) = bpр(уп,гр - уп,осн) или jп = bc(cп,гр - сп,осн), где bp, bc - коэфф. массоотдачи, p - давление смеси, рп - парциальное давление пара, yп = pп/p - молярная концентрация пара, cп = rп/r - массовая концентрация пара, rп, r - локальные плотности пара и смеси; индексы означают: "гр" - у границы раздела фаз, "осн" - в осн. массе смеси. Плотность потока теплоты, отдаваемой при И. жидкостью, составляет [в Дж/(м2.с)]: q = aж(tж - tгр) = rjп + aг (tгр — tг), где aж, aг - коэф. теплоотдачи со стороны жидкости и газа, Вт/(м2.К); r - теплота И., Дж/кг. При очень малых радиусах кривизны пов-сти И. (напр., при И. мелких капель жидкости) учитывается влияние поверхностного натяжения жидкости, приводящего к тому, что равновесное давление пара над пов-стью раздела выше давления насыщ. пара той же жидкости над плоской пов-стью. Если tгр ~ tж, то при расчете И. могут приниматься во внимание только тепло- и массообмен в газовой фазе. При относительно малой интенсивности массообмена приближенно справедлива аналогия между процессами тепло- и массопереноса, из к-рой следует: Nu/Nu0 = Sh*/Sh0, где Nu = aг l/lг - число Нуссельта, l - характерный размер пов-сти И., lг - коэф. теплопроводности парогазовой смеси, Sh* = bpyг,грl/Dp = bccг,грl/D - число Шервуда для диффузионной составляющей потока пара, Dp = D/RпT -коэф. диффузии, отнесенный к градиенту парциального давления пара. Значения bp и bс вычисляют по приведенным выше соотношениям, числа Nu0 и Sh0 соответствуют jп : 0 и могут определяться по данным для раздельно происходящих процессов тепло- и массообмена. Число Sh0 для суммарного (диффузионного и конвективного) потока пара находят делением Sh* на молярную (yг,гр) или массовую (сг,гр) концентрацию газа у пов-сти раздела в зависимости от того, к какой движущей силе массообмена отнесен коэф. b. Ур-ния подобия для Nu и Sh* при И. включают кроме обычных критериев (чисел Рейнольдса Re, Архимеда Аr, Прандтля Рr или Шмидта Sc и геом. параметров) параметры, учитывающие влияние поперечного потока пара и степени неоднородности парогазовой смеси (отношения мол. масс или газовых постоянных ее компонентов) на профили, скорости, т-ры или концентраций в сечении пограничного слоя. При малых jп, не нарушающих существенно гидродинамич. режим движения парогазовой смеси (напр., при испарении воды в атм. воздух) и подобие граничных условий полей т-р и концентраций, влияние дополнит. аргументов в ур-ниях подобия незначительно и им можно пренебречь, принимая, что Nu = Sh. При И. многокомпонентных смесей указанные закономерности сильно усложняются. При этом теплоты И. компонентов смеси и составы жидкой и парогазовой фаз, находящихся между собой в равновесии, различны и зависят от т-ры. При И. бинарной жидкой смеси образующаяся смесь паров относительно богаче более летучим компонентом, исключая только азеотропные смеси, испаряющиеся в точках экстремума (максимума или минимума) кривых состояния как чистая жидкость. Общее кол-во испаряющейся жидкости увеличивается с возрастанием пов-сти контакта жидкой и газовой фаз, поэтому конструкции аппаратов, в к-рых происходит И., предусматривают увеличение пов-сти И. путем создания большого зеркала жидкости, раздробления ее на струи и капли или образования тонких пленок, стекающих по пов-сти насадок. Возрастание интенсивности тепло- и массообмена при И. достигается также повышением скорости газовой среды относительно пов-сти жидкости. Однако увеличение этой скорости не должно приводить к чрезмерному уносу жидкости газовой средой и значит. повышению гидравлич. сопротивления аппарата. И. широко применяется в пром. практике для очистки в-в, сушки материалов, разделения жидких смесей, кондиционирования воздуха. Испарительное охлаждение воды используется в оборотных системах водоснабжения предприятий. См. также Выпаривание, Газов увлажнение, Градирни, Сушка. Лит.: Берман Л. Д., Испарительное охлаждение циркуляционной воды, 2 изд., М.-Л., 1957; Фукс Н. А., Испарение и рост капель в газообразной среде, М., 1958; Берд Р., Стьюарт В., Лайтфут Е., Явления переноса, пер. с англ., М., 1974; Берман Л. Д., "Теоретические основы хим. технологии", 1974, т.8, № 6, с. 811-22; Шервуд Т., Пигфорд Р., Уилки Ч., Массопередача, пер. с англ., М., 1982. Л. Д. Берман.

