Словарь научных терминов
Инициаторы радикальные
ИНИЦИАТОРЫ РАДИКАЛЬНЫЕ (от позднелат. initiator -зачинатель), в-ва, способные зарождать (инициировать) цепные радикальные процессы в результате распада или др. хим. р-ций образования радикалов свободных. К таким процессам относятся, напр., радикальная полимеризация, окисление орг. соединений, радикально-цепное хлорирование и сульфохлорирование, теломеризация, структурирование полимеров. Иногда термин "инициатор" используют для обозначения в-в, возбуждающих ионную полимеризацию, если они необратимо расходуются на стадии инициирования (см. Катализаторы полимеризации).
В качестве И. р. на практике чаще всего используют орг. и неорг. пероксиды, азосоединения, N-нитрозоанилиды, триазены, элементоорг. соед. (в т.ч. карбонилы металлов), дибензилы. Концентрация И. р. в среднем составляет 10-2 моль/л; при инициировании, напр., полимеризации метилметакрилата 2,2'-азо-бис-изобутиронитрилом она равна 10-3 — 5.10-1 моль/л, а бензоилпероксидом - 5.10-4 —10-1 моль/л, при инициировании полимеризации стирола бензоилпероксидом -10-4-2.10-1 моль/л.
Орг. пероксиды и азосоединения - наиб. распространенные И. р., из них в пром-сти широко применяют бензоилпероксид, трет-бутилгидропероксид, трет-бутилпероксид, кумилгидропероксид, кумилпероксид, 2,2'-азо-бис-изобутиронитрил; из неорг. пероксидов наиб. важен водорода пероксид, из элементоорганических ацетилциклогексилсульфонилпероксид C6H11SO2OOC(O)CH3 и три-(трет-бутилперокси)винилкремний (C4H9OO)3SiCH=CH2. В нек-рых процессах И. р. может служить О2. Своб. радикалы в большинстве случаев генерируются в результате термич. или фотохим. распада И. р. или при окислит.-восстановит. р-циях. О генерировании радикалов путем фотолиза см. Фотохимические реакции.
Пероксиды, азосоединения и дибензилы типа [С6Н5С(СН3)2-]2, [С6Н5С(СН3)(С2Н5)-]2 и [п-CH3OC6H4C(OC2H5)(CN)—]2, содержащие слабые связи соотв. О—О, С—N и С—С, используют для термич. генерирования своб. радикалов. При термолизе у пероксидов, как правило, первоначально гомолитически разрывается связь О—О (энергия активации Еакт = 115-170 кДж/моль), у азосоединений - обе связи С—N и выделяется N2 (Eакт = 110-145 кДж/моль). Распад при нагр., напр., N-нитрозоанилидов и триазенов происходит соотв. по ур-ниям:
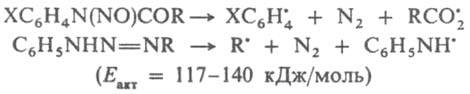
Своб. радикалы возникают также при разрыве лабильных связей в группировках —О—О—, —N=N— или др. предварительно введенных в макромолекулы полимеров. Эти р-ции используют для получения привитых и блоксополимеров, сетчатых полимеров. При проведении процесса в р-ре в результате клетки эффекта первичные радикальные продукты распада могут рекомбинировать и диспропорционировать, давая стабильные молекулы, что приводит к снижению эффективности инициирования. Р-ции в окислит.-восстановит. системах осуществляются с переносом одного электрона или частицы, несущей неспаренный электрон. В этих случаях образуется один радикал, что исключает эффект клетки. Участие в окислит.-восстановит. процессе одновременно двух и более молекул позволяет, варьируя их концентрации, легко регулировать суммарную скорость инициирования, а благодаря низким энергиям активаций лимитирующих стадий образования радикалов (30-45 кДж/моль) последние генерируются при комнатной и более низких т-рах. Ниже приведены окислит.-восстановит. системы, наиб. широко применяемые в качестве И. р. Система H2O2-FeSO4, наз. реактивом Фентона, генерирует радикалы по схеме:
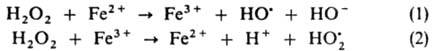
Стадия (1) лимитирует суммарную скорость процесса (Еакт = 39,3 кДж/моль). По аналогичной схеме происходит генерирование радикалов в системах гидропероксида кумола, диизопропилбензола или п-ментана в сочетании с FeSО4:
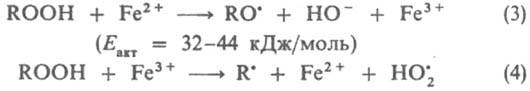
Общая скорость генерирования радикалов определяется скоростью восстановления Fe3+ в Fe2+, поэтому в пром. системы вводят дополнительно восстановители, напр., фруктозу и др. углеводы, гидразин, ронгалит NaHSO2.СН2О.2Н2О. Системы, состоящие из пероксодисульфатов и солей Fe(II), генерируют радикалы по схеме: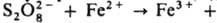
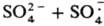 (Еакт = 50,7 кДж/моль).
В системах, содержащих бензоилперокрид или др. пероксиды ацилов в сочетании с диалкиланилином, перенос электрона осуществляется через промежуточный комплекс с образованием ион-радикальной пары по реакции:
(Еакт = 50,7 кДж/моль).
В системах, содержащих бензоилперокрид или др. пероксиды ацилов в сочетании с диалкиланилином, перенос электрона осуществляется через промежуточный комплекс с образованием ион-радикальной пары по реакции:
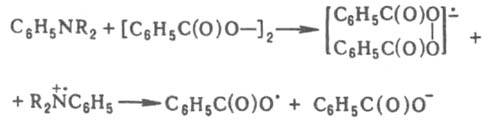
Карбонилы металлов переменной валентности генерируют радикалы в результате переноса электрона от металла к галогенсодержащим соед.:
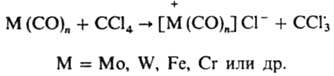
Их применяют главным образом для инициирования радикальной теломеризации с разрывом связей С—Hal, С—S, С—N. Мировое произ-во азосоединений достигло в 1985 неск. тыс. т, орг. пероксидов в США - ок. 20 тыс. т. Свыше половины общего объема выпускаемых в пром-сти полимерных материалов производится и перерабатывается с применением И. р. Лит.: Семенов Н. Н., О некоторых проблемах химической кинетики и реакционной способности, 2 изд., М., 1958; Розанцев Э. Г, Шолле В. Д., Органическая химия свободных радикалов, М., 1979; Долгоплоск Б. А., Тинякова Е. И., Генерирование свободных радикалов и их реакции, М., 1982; Антоновский В. Л., Инициаторы, М. (в печати). В. Л. Антоновский.
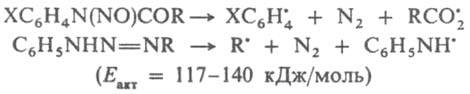
Своб. радикалы возникают также при разрыве лабильных связей в группировках —О—О—, —N=N— или др. предварительно введенных в макромолекулы полимеров. Эти р-ции используют для получения привитых и блоксополимеров, сетчатых полимеров. При проведении процесса в р-ре в результате клетки эффекта первичные радикальные продукты распада могут рекомбинировать и диспропорционировать, давая стабильные молекулы, что приводит к снижению эффективности инициирования. Р-ции в окислит.-восстановит. системах осуществляются с переносом одного электрона или частицы, несущей неспаренный электрон. В этих случаях образуется один радикал, что исключает эффект клетки. Участие в окислит.-восстановит. процессе одновременно двух и более молекул позволяет, варьируя их концентрации, легко регулировать суммарную скорость инициирования, а благодаря низким энергиям активаций лимитирующих стадий образования радикалов (30-45 кДж/моль) последние генерируются при комнатной и более низких т-рах. Ниже приведены окислит.-восстановит. системы, наиб. широко применяемые в качестве И. р. Система H2O2-FeSO4, наз. реактивом Фентона, генерирует радикалы по схеме:
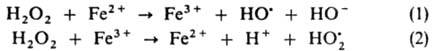
Стадия (1) лимитирует суммарную скорость процесса (Еакт = 39,3 кДж/моль). По аналогичной схеме происходит генерирование радикалов в системах гидропероксида кумола, диизопропилбензола или п-ментана в сочетании с FeSО4:
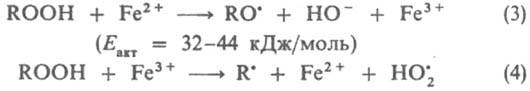
Общая скорость генерирования радикалов определяется скоростью восстановления Fe3+ в Fe2+, поэтому в пром. системы вводят дополнительно восстановители, напр., фруктозу и др. углеводы, гидразин, ронгалит NaHSO2.СН2О.2Н2О. Системы, состоящие из пероксодисульфатов и солей Fe(II), генерируют радикалы по схеме:
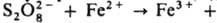
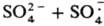 (Еакт = 50,7 кДж/моль).
В системах, содержащих бензоилперокрид или др. пероксиды ацилов в сочетании с диалкиланилином, перенос электрона осуществляется через промежуточный комплекс с образованием ион-радикальной пары по реакции:
(Еакт = 50,7 кДж/моль).
В системах, содержащих бензоилперокрид или др. пероксиды ацилов в сочетании с диалкиланилином, перенос электрона осуществляется через промежуточный комплекс с образованием ион-радикальной пары по реакции:
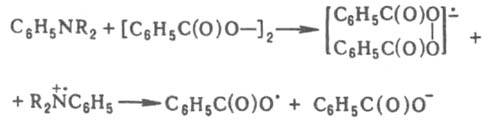
Карбонилы металлов переменной валентности генерируют радикалы в результате переноса электрона от металла к галогенсодержащим соед.:
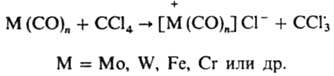
Их применяют главным образом для инициирования радикальной теломеризации с разрывом связей С—Hal, С—S, С—N. Мировое произ-во азосоединений достигло в 1985 неск. тыс. т, орг. пероксидов в США - ок. 20 тыс. т. Свыше половины общего объема выпускаемых в пром-сти полимерных материалов производится и перерабатывается с применением И. р. Лит.: Семенов Н. Н., О некоторых проблемах химической кинетики и реакционной способности, 2 изд., М., 1958; Розанцев Э. Г, Шолле В. Д., Органическая химия свободных радикалов, М., 1979; Долгоплоск Б. А., Тинякова Е. И., Генерирование свободных радикалов и их реакции, М., 1982; Антоновский В. Л., Инициаторы, М. (в печати). В. Л. Антоновский.
Иванова реакция
Игданит
Идеальный газ
Идентификация
Изатин
Изафенин
Избирательность анализа
Известковые удобрения
Известняк
Известь
Измельчение
Изо..
Изоmeризat
Изоамилацетат
Изоамиловый спирт
Изобутилен
Изобутиловый спирт
Изовалериановая кислота
Изовалериановый альдегид
Изоиндол
Изоксазол
Изолейцин
Изолированная система
Изолобальной аналогии принцип
Изоляционные масла
Изомасляный альдегид
Изомеразы
Изомеризация
Изомерия
Изомерия атомных ядер
Изоморфизм
Изоникотиновая кислота
Изонитрилы
Изонитрильные комплексы переходных металлов
Изопрен
Изопреновые каучуки синтетические
Изопреноиды
Изопропаноламины
Изопропилбензол
Изопропиловый спирт
Изотактические полимеры
Изотахофорез
Изотиазол
Изотиоцианаты
Изотопного разбавления метод
Изотопные генераторы
Изотопные индикаторы
Изотопные эффекты
Изотопный анализ
Изотопный обмен
Изотопов разделение
Изотопы
Изоферменты
Изофталевая кислота
Изофталоилхлорид
Изохинолин
Изохинолиновые алкалоиды
Изоцианаты
Изоцианаты блокированные
Изоцинхомероновая кислота
Изоцитрат-лиаза
Изоэвгенол
Изоэлектрическая точка
Изумрудная зелень
Илиды
Имид-амидная перегруппировка
Имидазол
Имидазолины
Имидофосфаты
Имиды карболовых кислот
Имиды металлов
Имизин
Иминиевые соли
Иминоксильные радикалы
Иминоэфиры
Иммерсионные жидкости
Иммобилизованные ферменты
Иммуномодулирующие средства
Иммунохимия
Импедансный метод
Импульсный радиолиз
Импульсный фотолиз
Ингибиторы
Ингибиторы коррозии
Индазол
Индамины
Индан
Индандионы
Индантрон
Инден
Индиго
Индигоидные красители
Индигокармин
Индий
Индикаторная бумага
Индикаторные трубки
Индикаторы
Индия антимонид
Индия арсенид
Индия галогениды
Индия оксиды
Индия фосфид
Индоанилины
Индоксан
Индол
Индольные алкалоиды
Индофенолы
Индуктивный эффект
Индукция химическая
Индулины
Индустриальные масла
Инженерная энзимология
Инициаторы радикальные
Инициирование
Инициирующие взрывчатые вещества
Инкапаситанты
Инозин
Инозиты
Инсектициды
Инсулин
Интенсивные параметры
Интеркалаты
Интерлейкины
Интермедиат
Интерметаллиды
Интерфероны
Инулин
Инфразвуковые аппараты
Инфракрасная спектроскопия
Иод
Иодбензол
Иодиды
Иодное число
Иодные удобрения
Иодозобензол
Иодометрия
Ион-молекулярные комплексы
Ион-радикалы
Ион-циклотронный резонанс
Ионизации потенциал
Ионизирующие излучения
Иониты
Ионная атмосфера
Ионная имплантация
Ионная полимеризация
Ионная хроматография
Ионно-молекулярные реакции
Ионного рассеяния спектроскопия
Ионные кристаллы
Ионные пары
Ионные радиусы
Ионный выход
Ионный микроанализ
Ионный обмен
Ионол
Иономеры
Ионометрия
Иононы
Ионообменная хроматография
Ионообменные смолы
Ионоселективные электроды
Ионофоры
Ионы
Ионы в газах
Иоцича реакция
Иприт
Ипсо-замещение
Иридий
Иридийорганические соединения
Ирисаль
Ирританты
Искусственная пища
Искусственные волокна
Искусственный интеллект
Испарение
Итаконовая кислота
Иттербий
Иттрий
Ихтиоциды
Июпак

