Словарь научных терминов
Индикаторы
ИНДИКАТОРЫ (позднелат. indicator - указатель), хим. в-ва, изменяющие окраску, люминесценцию или образующие осадок при изменении концентрации к.-л. компонента в р-ре. Указывают на определенное состояние системы или на момент достижения этого состояния.
Различают И. обратимые и необратимые. Изменение окраски первых при изменении состояния системы (напр., фенолфталеина при изменении рН среды) м. б. повторено многократно. Необратимые И. подвергаются необратимым хим. превращениям, напр., азосоединения при окислении ионами BrO3- разрушаются. Индикаторы, к-рые вводят в исследуемый р-р, наз. внутренними, в отличие от внешних, р-цию с к-рыми проводят вне анализируемой смеси. В последнем случае одну или неск. капель анализируемого р-ра помещают на бумажку, пропитанную И., или смешивают их на белой фарфоровой пластинке с каплей индикатора.
И. применяют чаще всего для установления конца к.-л. хим. р-ции, гл. обр. конечной точки титрования (к. т. т.). В соответствии с титриметрич. методами различают кислотно-основные, адсорбц., окислит.-восстановит. и комплексонометрич. И.
Кислотно-основные И. представляют собой р-римые орг соед., к-рые меняют свой цвет или люминесценцию в зависимости от концентрации ионов Н+ (рН среды). Примен. для установления конца р-ции между к-тами и основаниями (в т. ч. при кислотно-основном титровании) или др. р-ций, если в них участвуют ионы Н+, а также для колориметрич. определения рН водных р-ров. Наиб. важные кислотно-основные И. приведены в табл. 1. Причина изменения цвета И. в том, что присоединение или отдача протонов его молекулами связаны с заменой одних хромофорных групп другими или с появлением новых хромофорных групп.
Если И. слабая к-та HIn, то в водном р-ре имеет место равновесие: HIn + Н2О D In- + Н3О+ . Если И. - слабое основание In, то: In + H2O D HIn+ + ОН-. В общем виде можно записать: Ina + Н2О D Inb + Н3О+, где Ina и Inb - соотв. кислая и основная формы И., к-рые окрашены различно. Константа равновесия этого процесса Кln = [Inb][H3O+]/[Ina] наз. константой И. Цвет р-ра зависит от соотношения [Ina]/[Inb], к-рое определяется рН р-ра.
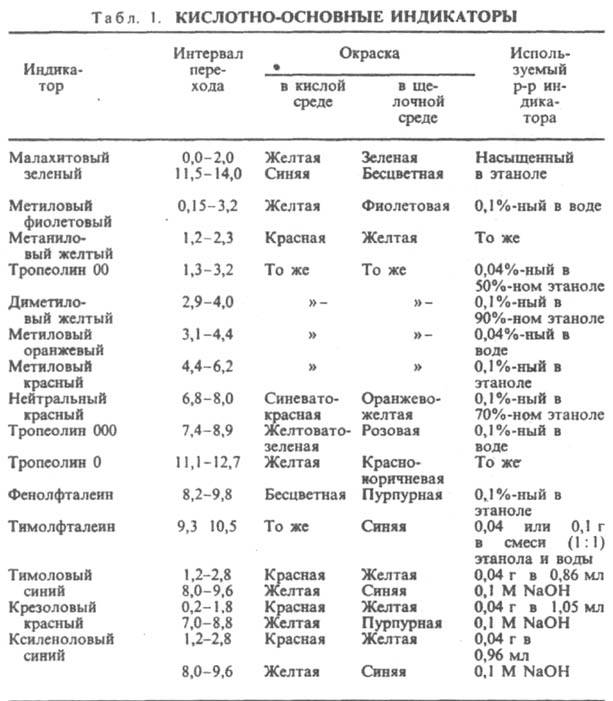
Считают, что цвет одной формы И. заметен, если ее концентрация в 10 раз превышает концентрацию др. формы, т.е. если отношение [Ina]/[Inb] = [H3O+]/Kln равно 0,1 или 10. Изменение цвета И. отмечается в области рН = рКlп b 1, к-рый наз. интервалом перехода И. Изменение наиб. отчетливо, когда [Ina] = [Inb] и Кln = [Н3О]+, т.е. при рН = рКln. Значение рН, при к-ром обычно заканчивается титрование, наз. показателем титрования рТ. И. для титрования подбирают таким образом, чтобы интервал перехода окраски включал значение рН, какое должен иметь р-р в точке эквивалентности. Часто это значение рН не совпадает с рТ используемого индикатора, что приводит к т. наз. индикаторной ошибке. Если в к. т. т. остается избыток неоттитрованного слабого основания или к-ты, ошибка наз. соотв. основной или кислотной. Чувствительность И. - концентрация (в моль/л) определяемого иона (в данном случае Н+ или ОН- ) в точке наиб. резкого перехода окраски. Различают: чувствительные к к-там И. с интервалом перехода в области щелочных значений рН (напр., фенолфталеин, тимолфталеин); чувствительные к основаниям И. с интервалом перехода в кислой области (как у диметилового желтого, метилового оранжевого и др.); нейтральные И., интервал перехода к-рых находится ок. рН 7 (нейтральный красный, феноловый красный и др.). И. бывают с одной или двумя окрашенными формами; такие И. наз. соотв. одноцветными и двухцветными. Наиб. четкое изменение окраски наблюдалось бы у тех И., кислотная и основная формы к-рых окрашены в дополнит. цвета. Однако таких И. не существует. Поэтому, добавляя краситель, изменяют соответствующим образом окраски обеих форм. Так, у метилового красного переход от красного к желтому происходит в интервале 2 единиц рН, а если к р-ру добавить метиленовый синий, то переход окраски от красно-фиолетовой к зеленой наблюдается резко и отчетливо при рН 5,3. Подобного эффекта можно добиться, если использовать смесь двух индикаторов, цвета к-рых дополняют дру. друга. Такие И. наз. смешанными (табл. 2).

Смеси И., к-рые непрерывно изменяют свой цвет во всей области значений рН от 1 до 14, наз. универсальными. Их используют для приблизит. оценки рН р-ров. На изменение окраски И. оказывают влияние его концентрации. Для двухцветных И. чем выше концентрация, тем изменение окраски менее резко, т.к. спектры поглощения обеих форм накладываются друг на друга в большей степени и становится труднее определить изменение окраски. Обычно используют одно и то же минимальное (неск. капель р-ра) кол-во И. Интервал перехода многих И. зависит от т-ры. Так, метиловый оранжевый меняет свою окраску при комнатной т-ре в интервале рН 3,4-4,4, а при 100 °С в интервале рН 2,5-3,3. Это связано с изменением ионного произведения воды. Присутствующие в р-ре коллоидные частицы адсорбируют И., что приводит к полному изменению его цвета. Для исключения ошибки в присут. положительно заряженных коллоидных частиц следует применять И.-основания, а в присут. отрицательно заряженных - И.-кислоты. При титровании в обычных условиях необходимо учитывать влияние растворенного СО2, особенно при использовании И. с рКln > 4 (напр., метилового оранжевого, метилового красного, фенолфталеина). Иногда СО2 предварительно удаляют кипячением или титруют р-р в отсутствие контакта с атмосферой. Влияние посторонних нейтральных электролитов (солевой эффект) проявляется в смещении равновесия И. В случае И.-кислот интервал перехода смещается в более кислую область, а в случае И.-оснований - в более щелочную. В зависимости от природы р-рителя меняются окраски И., их рКln и чувствительность. Так, метиловый красный в воде дает переход окраски при более высоких значениях активности ионов Н+ , чем бромфеноловый синий, а в этиленгликолевом р-ре наоборот. В водно-метанольных и водно-этанольных р-рах изменение по сравнению с водной средой незначительно. В спиртовой среде И.-кислоты более чувствительны к ионам Н+ , чем И.-основания. Хотя при титровании в неврдных средах обычно к. т. т. устанавливают потенциометрически с помощью стеклянного индикаторного электрода, используют также кислотно-основные И. (табл. 3). Чаще всего для титрования слабых оснований применяют метиловый красный в диоксане или кристаллический фиолетовый в безводной СН3СООН; при титровании слабых к-т - тимоловый синий в ДМФА. Поведение И. в неводной и водной средах аналогично. Напр., для слабой к-ты HIn в р-рителе SН можно записать равновесие: HIn + SH D In- + SH2+. Механизм действия И. такой же, как и в воде, только в неводных средах пользуются соответствующими шкалами кислотности (рНр, рА; см. Кислотно-основное титрование). В качестве кислотно-основных И. используют также люминесцентные индикаторы, меняющие цвет и интенсивность флуоресценции в зависимости от рН и позволяющие титровать сильно окрашенные и мутные р-ры.

Для титрования слабых к-т применяются т наз. индикаторы помутнения в-ва, образующие обратимые коллоидные системы, коагулирующие в очень узком интервале рН (напр., изонитроацетил-n-аминобензол дает муть при рН 10,7-11,0). В качестве кислотно-основных И. можно использовать комплексы металлов с металлохромными индикаторами (см. ниже); эти комплексы, разрушаясь, изменяют окраску р-ра в узком интервале рН. Для определения орг. к-т и оснований в воде в присут. несмешивающегося с ней р-рителя применяют т. наз. амфииндикаторы, к-рые представляют собой соли И.-кислот (напр., тропеолина 00) с разл. орг. основаниями (напр., алкалоидами). Эти И. хорошо раств. в орг. р-рителях, плохо в воде; отличаются высокой чувствительностью. Адсорбционные И. в-ва, способные адсорбироваться на пов-сти осадка и менять при этом окраску или интенсивность люминесценции Эти И., как правило, обратимы и используются в осадительном титровании В первую очередь осадком адсорбируются ионы, идентичные тем, к-рые входят в состав самого осадка, после чего адсорбируется И. Большая группа И. красители (табл. 4), адсорбирующиеся пов-стью осадка с образованием солей с ионами, содержащимися в осадке.

Напр., р-р эозина розового цвета, к-рый не меняется при добавлении AgNO3. Но при титровании р-ром КВr выпадающий осадок адсорбирует ионы Ag+, к-рые присоединяют к себе анионы эозина. Осадок при этом становится красно-фиолетовым. В к. т. т., когда оттитрованы все ионы Ag+, окраска осадка исчезает и р-р становится снова розовым. Неорг. адсорбц. И. образуют с ионами титранта цветной осадок или комплекс (как, напр., применяемые в качестве индикаторов ионы СrО4- и SCN- в аргентометрии). В качестве адсорбц. И. применяются также нек-рые кислотно-основные, окислит.-восстановит. и комплексонометрич. индикаторы, св-ва к-рых (константы кислотной диссоциации, окислит.-восстановит. потенциалы и константы устойчивости комплексов с катионами металлов) в адсорбир. состоянии зависят от природы и концентрации ионов на пов-сти осадка. Окислит.-восстановит. И. - в-ва, способные изменять окраску в зависимости от окислит.-восстановит. потенциала р-ра. Применяют для установления к. т. т. окислит.-восстановит. титрования и для колориметрич. определения окислит.-восстановит. потенциала (преим. в биологии). Такими И. служат, как правило, в-ва, к-рые сами подвергаются окислению или восстановлению, причем окисленная (InOх) и восстановленная (InRed) формы имеют разные окраски. Для обратимых окислит.-восстановит. И. можно записать: InOх + ne D InRed , где п - число электронов. При потенциале Е отношение концентраций обеих форм И. определяется Нернста уравнением:
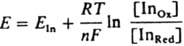 ,
,
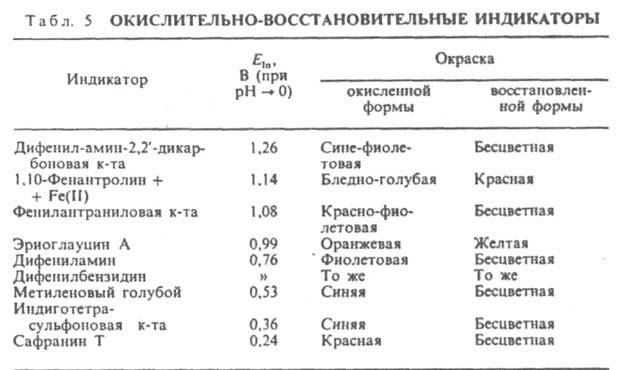
где Eln - реальный окислит.-восстановит. потенциал индикатора, зависящий от состава р-ра. Интервал перехода окраски практически наблюдается при изменении отношения [In0x]/[InRed] от 0,1 до 10, что при 25 °С соответствует DE (в В) = Eln b (0,059/n). Потенциал, соответствующий самому резкому изменению цвета, равен Eln. При выборе И. учитывают гл. обр. значения Eln, коэф. молярного погашения обеих форм И. и потенциал р-ра в точке эквивалентности. При титровании сильными окислителями (К2Сr2О7, КМnО4 и др.) применяют И., имеющие сравнительно высокие Eln, напр., дифениламин и его производные; при титровании сильными восстановителями [солями Ti(III), V(II) и т.д.] применяют И. с относительно низкими Eln, напр., сафранин, метиленовый голубой (табл. 5).
Нек-рые в-ва изменяют свою окраску необратимо, напр., при окислении разрушаются с образованием бесцв. продуктов, как индиго под действием гипохлоритов или нафтоловый сине-черный под действием ионов ВrО3. Комплексонометрические И. - в-ва, образующие с ионами металлов (М) окрашенные комплексы, по цвету отличающиеся от самих И. Применяются для установления к. т. т. в комплексонометрии. Устойчивость комплексов металлов с И. (In) меньше, чем соответствующих комплексoнатов, поэтому в к. т. т. комплексоны вытесняют И. из комплексов с металлами. В момент изменения окраски в точке эквивалентности [In] = [MIn] и, следовательно, рМ = — lg KMln, где рМ = — lg[M] наз. точкой перехода И., КMln - константа устойчивости комплекса металла с И. Ошибка при титровании связана с тем, что нек-рое кол-во иона металла может присоединяться к И., а не к титранту. Наиб. часто используют т. наз. металлохромные И. (табл. 6) - орг. в-ва, образующие с катионами металлов р-римые в воде интенсивно окрашенные (el 104-105) внутрикомплексные соединения. Эти соед. должны быть достаточно устойчивы, чтобы образовываться при очень низких концентрациях ионов металлов. Индикатор и его комплекс должны находиться в истинном р-ре. Дня повышения р-римости реагента и комплекса обычно вводят смешивающийся с водой р-ритель. Комплекс металла с И. должен быть лабильным и быстро разрушаться под действием комплексона. Различают селективные и универсальные металлохромные И., взаимодействующие соотв. с небольшим числом или с мн. катионами. К первым относятся, напр., тайрон, галлион, ко вторым - арсеназо I, пиридилазонафтол (ПАН), пирокатехиновый фиолетовый, ксиленоловый оранжевый, метилтимоловый синий, хромазурол и др.

Иногда в качестве комплексонометрич. И. применяют комплексонат к.-л. иона (напр., [CuY]2- , где Y - анион этилендиаминтетрауксусной к-ты) в смеси с металлохромным И., напр. ПАН. При введении определяемого иона М2+ происходит р-ция: М2+ + [CuY]2- + ПАН D [MY]2- + [СuПАН]+. При титровании к.-л. комплексоном в к. т. т. окраска р-ра меняется от фиолетовой к желто-оранжевой, т.е. очень контрастно. При комплексонометрич. определении Сu используют в качестве индикатора ее комплекс с ПАН, адсорбированный на пов-сти осажденного AgI. В этом случае можно определять Ag и Сu при совместном присутствии: в кислой среде р-ром KI оттитровывают сначала ионы Ag, а затем комплексоном - ионы Сu. Применяются также т. наз. неокрашенные комплексонометрич. И., избирательно взаимодействующие с ионами определяемого металла с образованием слабо окрашенных (el 103) комплексов, напр., сульфосалициловая кислота при титровании Fe (III). Флуоресцентные комплексонометрич. И. (или металлофлуоресцентные И.) взаимод. с катионами металлов с образованием интенсивно флуоресцирующих хелатов (см. Люминесцентные индикаторы). Впервые об И. сообщил англ. физик и химик Р. Бойль в 1664. О применении И. на носителях см. Реактивные индикаторные бумаги и Индикаторные трубки. Лит.: Индикаторы, пер. с англ., т. 1-2, М., 1976; Денеш И., Титрование в неводных средах, пер. с англ., М., 1971; Коренман И. М., Новые титриметрические методы, М., 1983. Л. Н. Симонова.

Считают, что цвет одной формы И. заметен, если ее концентрация в 10 раз превышает концентрацию др. формы, т.е. если отношение [Ina]/[Inb] = [H3O+]/Kln равно 0,1 или 10. Изменение цвета И. отмечается в области рН = рКlп b 1, к-рый наз. интервалом перехода И. Изменение наиб. отчетливо, когда [Ina] = [Inb] и Кln = [Н3О]+, т.е. при рН = рКln. Значение рН, при к-ром обычно заканчивается титрование, наз. показателем титрования рТ. И. для титрования подбирают таким образом, чтобы интервал перехода окраски включал значение рН, какое должен иметь р-р в точке эквивалентности. Часто это значение рН не совпадает с рТ используемого индикатора, что приводит к т. наз. индикаторной ошибке. Если в к. т. т. остается избыток неоттитрованного слабого основания или к-ты, ошибка наз. соотв. основной или кислотной. Чувствительность И. - концентрация (в моль/л) определяемого иона (в данном случае Н+ или ОН- ) в точке наиб. резкого перехода окраски. Различают: чувствительные к к-там И. с интервалом перехода в области щелочных значений рН (напр., фенолфталеин, тимолфталеин); чувствительные к основаниям И. с интервалом перехода в кислой области (как у диметилового желтого, метилового оранжевого и др.); нейтральные И., интервал перехода к-рых находится ок. рН 7 (нейтральный красный, феноловый красный и др.). И. бывают с одной или двумя окрашенными формами; такие И. наз. соотв. одноцветными и двухцветными. Наиб. четкое изменение окраски наблюдалось бы у тех И., кислотная и основная формы к-рых окрашены в дополнит. цвета. Однако таких И. не существует. Поэтому, добавляя краситель, изменяют соответствующим образом окраски обеих форм. Так, у метилового красного переход от красного к желтому происходит в интервале 2 единиц рН, а если к р-ру добавить метиленовый синий, то переход окраски от красно-фиолетовой к зеленой наблюдается резко и отчетливо при рН 5,3. Подобного эффекта можно добиться, если использовать смесь двух индикаторов, цвета к-рых дополняют дру. друга. Такие И. наз. смешанными (табл. 2).

Смеси И., к-рые непрерывно изменяют свой цвет во всей области значений рН от 1 до 14, наз. универсальными. Их используют для приблизит. оценки рН р-ров. На изменение окраски И. оказывают влияние его концентрации. Для двухцветных И. чем выше концентрация, тем изменение окраски менее резко, т.к. спектры поглощения обеих форм накладываются друг на друга в большей степени и становится труднее определить изменение окраски. Обычно используют одно и то же минимальное (неск. капель р-ра) кол-во И. Интервал перехода многих И. зависит от т-ры. Так, метиловый оранжевый меняет свою окраску при комнатной т-ре в интервале рН 3,4-4,4, а при 100 °С в интервале рН 2,5-3,3. Это связано с изменением ионного произведения воды. Присутствующие в р-ре коллоидные частицы адсорбируют И., что приводит к полному изменению его цвета. Для исключения ошибки в присут. положительно заряженных коллоидных частиц следует применять И.-основания, а в присут. отрицательно заряженных - И.-кислоты. При титровании в обычных условиях необходимо учитывать влияние растворенного СО2, особенно при использовании И. с рКln > 4 (напр., метилового оранжевого, метилового красного, фенолфталеина). Иногда СО2 предварительно удаляют кипячением или титруют р-р в отсутствие контакта с атмосферой. Влияние посторонних нейтральных электролитов (солевой эффект) проявляется в смещении равновесия И. В случае И.-кислот интервал перехода смещается в более кислую область, а в случае И.-оснований - в более щелочную. В зависимости от природы р-рителя меняются окраски И., их рКln и чувствительность. Так, метиловый красный в воде дает переход окраски при более высоких значениях активности ионов Н+ , чем бромфеноловый синий, а в этиленгликолевом р-ре наоборот. В водно-метанольных и водно-этанольных р-рах изменение по сравнению с водной средой незначительно. В спиртовой среде И.-кислоты более чувствительны к ионам Н+ , чем И.-основания. Хотя при титровании в неврдных средах обычно к. т. т. устанавливают потенциометрически с помощью стеклянного индикаторного электрода, используют также кислотно-основные И. (табл. 3). Чаще всего для титрования слабых оснований применяют метиловый красный в диоксане или кристаллический фиолетовый в безводной СН3СООН; при титровании слабых к-т - тимоловый синий в ДМФА. Поведение И. в неводной и водной средах аналогично. Напр., для слабой к-ты HIn в р-рителе SН можно записать равновесие: HIn + SH D In- + SH2+. Механизм действия И. такой же, как и в воде, только в неводных средах пользуются соответствующими шкалами кислотности (рНр, рА; см. Кислотно-основное титрование). В качестве кислотно-основных И. используют также люминесцентные индикаторы, меняющие цвет и интенсивность флуоресценции в зависимости от рН и позволяющие титровать сильно окрашенные и мутные р-ры.

Для титрования слабых к-т применяются т наз. индикаторы помутнения в-ва, образующие обратимые коллоидные системы, коагулирующие в очень узком интервале рН (напр., изонитроацетил-n-аминобензол дает муть при рН 10,7-11,0). В качестве кислотно-основных И. можно использовать комплексы металлов с металлохромными индикаторами (см. ниже); эти комплексы, разрушаясь, изменяют окраску р-ра в узком интервале рН. Для определения орг. к-т и оснований в воде в присут. несмешивающегося с ней р-рителя применяют т. наз. амфииндикаторы, к-рые представляют собой соли И.-кислот (напр., тропеолина 00) с разл. орг. основаниями (напр., алкалоидами). Эти И. хорошо раств. в орг. р-рителях, плохо в воде; отличаются высокой чувствительностью. Адсорбционные И. в-ва, способные адсорбироваться на пов-сти осадка и менять при этом окраску или интенсивность люминесценции Эти И., как правило, обратимы и используются в осадительном титровании В первую очередь осадком адсорбируются ионы, идентичные тем, к-рые входят в состав самого осадка, после чего адсорбируется И. Большая группа И. красители (табл. 4), адсорбирующиеся пов-стью осадка с образованием солей с ионами, содержащимися в осадке.

Напр., р-р эозина розового цвета, к-рый не меняется при добавлении AgNO3. Но при титровании р-ром КВr выпадающий осадок адсорбирует ионы Ag+, к-рые присоединяют к себе анионы эозина. Осадок при этом становится красно-фиолетовым. В к. т. т., когда оттитрованы все ионы Ag+, окраска осадка исчезает и р-р становится снова розовым. Неорг. адсорбц. И. образуют с ионами титранта цветной осадок или комплекс (как, напр., применяемые в качестве индикаторов ионы СrО4- и SCN- в аргентометрии). В качестве адсорбц. И. применяются также нек-рые кислотно-основные, окислит.-восстановит. и комплексонометрич. индикаторы, св-ва к-рых (константы кислотной диссоциации, окислит.-восстановит. потенциалы и константы устойчивости комплексов с катионами металлов) в адсорбир. состоянии зависят от природы и концентрации ионов на пов-сти осадка. Окислит.-восстановит. И. - в-ва, способные изменять окраску в зависимости от окислит.-восстановит. потенциала р-ра. Применяют для установления к. т. т. окислит.-восстановит. титрования и для колориметрич. определения окислит.-восстановит. потенциала (преим. в биологии). Такими И. служат, как правило, в-ва, к-рые сами подвергаются окислению или восстановлению, причем окисленная (InOх) и восстановленная (InRed) формы имеют разные окраски. Для обратимых окислит.-восстановит. И. можно записать: InOх + ne D InRed , где п - число электронов. При потенциале Е отношение концентраций обеих форм И. определяется Нернста уравнением:
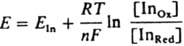 ,
, где Eln - реальный окислит.-восстановит. потенциал индикатора, зависящий от состава р-ра. Интервал перехода окраски практически наблюдается при изменении отношения [In0x]/[InRed] от 0,1 до 10, что при 25 °С соответствует DE (в В) = Eln b (0,059/n). Потенциал, соответствующий самому резкому изменению цвета, равен Eln. При выборе И. учитывают гл. обр. значения Eln, коэф. молярного погашения обеих форм И. и потенциал р-ра в точке эквивалентности. При титровании сильными окислителями (К2Сr2О7, КМnО4 и др.) применяют И., имеющие сравнительно высокие Eln, напр., дифениламин и его производные; при титровании сильными восстановителями [солями Ti(III), V(II) и т.д.] применяют И. с относительно низкими Eln, напр., сафранин, метиленовый голубой (табл. 5).

Нек-рые в-ва изменяют свою окраску необратимо, напр., при окислении разрушаются с образованием бесцв. продуктов, как индиго под действием гипохлоритов или нафтоловый сине-черный под действием ионов ВrО3. Комплексонометрические И. - в-ва, образующие с ионами металлов (М) окрашенные комплексы, по цвету отличающиеся от самих И. Применяются для установления к. т. т. в комплексонометрии. Устойчивость комплексов металлов с И. (In) меньше, чем соответствующих комплексoнатов, поэтому в к. т. т. комплексоны вытесняют И. из комплексов с металлами. В момент изменения окраски в точке эквивалентности [In] = [MIn] и, следовательно, рМ = — lg KMln, где рМ = — lg[M] наз. точкой перехода И., КMln - константа устойчивости комплекса металла с И. Ошибка при титровании связана с тем, что нек-рое кол-во иона металла может присоединяться к И., а не к титранту. Наиб. часто используют т. наз. металлохромные И. (табл. 6) - орг. в-ва, образующие с катионами металлов р-римые в воде интенсивно окрашенные (el 104-105) внутрикомплексные соединения. Эти соед. должны быть достаточно устойчивы, чтобы образовываться при очень низких концентрациях ионов металлов. Индикатор и его комплекс должны находиться в истинном р-ре. Дня повышения р-римости реагента и комплекса обычно вводят смешивающийся с водой р-ритель. Комплекс металла с И. должен быть лабильным и быстро разрушаться под действием комплексона. Различают селективные и универсальные металлохромные И., взаимодействующие соотв. с небольшим числом или с мн. катионами. К первым относятся, напр., тайрон, галлион, ко вторым - арсеназо I, пиридилазонафтол (ПАН), пирокатехиновый фиолетовый, ксиленоловый оранжевый, метилтимоловый синий, хромазурол и др.

Иногда в качестве комплексонометрич. И. применяют комплексонат к.-л. иона (напр., [CuY]2- , где Y - анион этилендиаминтетрауксусной к-ты) в смеси с металлохромным И., напр. ПАН. При введении определяемого иона М2+ происходит р-ция: М2+ + [CuY]2- + ПАН D [MY]2- + [СuПАН]+. При титровании к.-л. комплексоном в к. т. т. окраска р-ра меняется от фиолетовой к желто-оранжевой, т.е. очень контрастно. При комплексонометрич. определении Сu используют в качестве индикатора ее комплекс с ПАН, адсорбированный на пов-сти осажденного AgI. В этом случае можно определять Ag и Сu при совместном присутствии: в кислой среде р-ром KI оттитровывают сначала ионы Ag, а затем комплексоном - ионы Сu. Применяются также т. наз. неокрашенные комплексонометрич. И., избирательно взаимодействующие с ионами определяемого металла с образованием слабо окрашенных (el 103) комплексов, напр., сульфосалициловая кислота при титровании Fe (III). Флуоресцентные комплексонометрич. И. (или металлофлуоресцентные И.) взаимод. с катионами металлов с образованием интенсивно флуоресцирующих хелатов (см. Люминесцентные индикаторы). Впервые об И. сообщил англ. физик и химик Р. Бойль в 1664. О применении И. на носителях см. Реактивные индикаторные бумаги и Индикаторные трубки. Лит.: Индикаторы, пер. с англ., т. 1-2, М., 1976; Денеш И., Титрование в неводных средах, пер. с англ., М., 1971; Коренман И. М., Новые титриметрические методы, М., 1983. Л. Н. Симонова.
Иванова реакция
Игданит
Идеальный газ
Идентификация
Изатин
Изафенин
Избирательность анализа
Известковые удобрения
Известняк
Известь
Измельчение
Изо..
Изоmeризat
Изоамилацетат
Изоамиловый спирт
Изобутилен
Изобутиловый спирт
Изовалериановая кислота
Изовалериановый альдегид
Изоиндол
Изоксазол
Изолейцин
Изолированная система
Изолобальной аналогии принцип
Изоляционные масла
Изомасляный альдегид
Изомеразы
Изомеризация
Изомерия
Изомерия атомных ядер
Изоморфизм
Изоникотиновая кислота
Изонитрилы
Изонитрильные комплексы переходных металлов
Изопрен
Изопреновые каучуки синтетические
Изопреноиды
Изопропаноламины
Изопропилбензол
Изопропиловый спирт
Изотактические полимеры
Изотахофорез
Изотиазол
Изотиоцианаты
Изотопного разбавления метод
Изотопные генераторы
Изотопные индикаторы
Изотопные эффекты
Изотопный анализ
Изотопный обмен
Изотопов разделение
Изотопы
Изоферменты
Изофталевая кислота
Изофталоилхлорид
Изохинолин
Изохинолиновые алкалоиды
Изоцианаты
Изоцианаты блокированные
Изоцинхомероновая кислота
Изоцитрат-лиаза
Изоэвгенол
Изоэлектрическая точка
Изумрудная зелень
Илиды
Имид-амидная перегруппировка
Имидазол
Имидазолины
Имидофосфаты
Имиды карболовых кислот
Имиды металлов
Имизин
Иминиевые соли
Иминоксильные радикалы
Иминоэфиры
Иммерсионные жидкости
Иммобилизованные ферменты
Иммуномодулирующие средства
Иммунохимия
Импедансный метод
Импульсный радиолиз
Импульсный фотолиз
Ингибиторы
Ингибиторы коррозии
Индазол
Индамины
Индан
Индандионы
Индантрон
Инден
Индиго
Индигоидные красители
Индигокармин
Индий
Индикаторная бумага
Индикаторные трубки
Индикаторы
Индия антимонид
Индия арсенид
Индия галогениды
Индия оксиды
Индия фосфид
Индоанилины
Индоксан
Индол
Индольные алкалоиды
Индофенолы
Индуктивный эффект
Индукция химическая
Индулины
Индустриальные масла
Инженерная энзимология
Инициаторы радикальные
Инициирование
Инициирующие взрывчатые вещества
Инкапаситанты
Инозин
Инозиты
Инсектициды
Инсулин
Интенсивные параметры
Интеркалаты
Интерлейкины
Интермедиат
Интерметаллиды
Интерфероны
Инулин
Инфразвуковые аппараты
Инфракрасная спектроскопия
Иод
Иодбензол
Иодиды
Иодное число
Иодные удобрения
Иодозобензол
Иодометрия
Ион-молекулярные комплексы
Ион-радикалы
Ион-циклотронный резонанс
Ионизации потенциал
Ионизирующие излучения
Иониты
Ионная атмосфера
Ионная имплантация
Ионная полимеризация
Ионная хроматография
Ионно-молекулярные реакции
Ионного рассеяния спектроскопия
Ионные кристаллы
Ионные пары
Ионные радиусы
Ионный выход
Ионный микроанализ
Ионный обмен
Ионол
Иономеры
Ионометрия
Иононы
Ионообменная хроматография
Ионообменные смолы
Ионоселективные электроды
Ионофоры
Ионы
Ионы в газах
Иоцича реакция
Иприт
Ипсо-замещение
Иридий
Иридийорганические соединения
Ирисаль
Ирританты
Искусственная пища
Искусственные волокна
Искусственный интеллект
Испарение
Итаконовая кислота
Иттербий
Иттрий
Ихтиоциды
Июпак

