Словарь научных терминов
Ингибиторы
ИНГИБИТОРЫ (от лат mhibeo - останавливаю, сдерживаю), в-ва, тормозящие хим. р-ции. Ингибирование характерно для каталитич и цепных р-ций, к-рые протекают с
участием активных центров или активных частиц. Тормозящее действие обусловлено тем, что И. блокирует активные центры катализатора или реагирует с активными частицами с образованием малоактивных радикалов, не способных продолжать цепь. И. вводится в систему в концентрации много меньшей, чем концентрации реагирующих в-в (10-2-10-5 моль%).
Кинетика р-ций с участием И. принципиально различна для каталитических и цепных р-ций. В каталитич. р-ции число активных центров фиксировано и И., блокируя часть из них, не расходуется в ходе процесса. Поэтому при введении И. скорость р-ции снижается, а затем процесс протекает длит. время с постоянной скоростью. В нек-рых случаях эта скорость может медленно возрастать из-за расходования И. по к.-л. побочной р-ции. В цепной р-ции активные частицы непрерывно генерируются, что приводит к расходованию И. и постепенному самоускорению р-ции (в случае цепной неразветвленной р-ции обычно восстанавливается исходная скорость).
Ингибирование цепных реакций. Длительность t тормозящего действия И. наз. периодом индукции; число цепей f, к-рые обрывает одна молекула И., последовательно вступая в р-ции обрыва, наз. стехиометрич. коэф. ингибирования. При исходной концентрации И. [И]0 и скорости инициирования цепей vi период индукции равен: t = f [И]0/vi. Напр., хинон тормозит полимеризацию виниловых мономеров, вступая в след. р-ции:
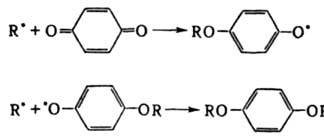
В этом случае f= 2 и t = 2[И]0/vi. В нек-рых системах происходит регенерация И. в р-циях обрыва цепи, в результате чего одна молекула И. и образующийся из нее радикал многократно участвуют в р-циях обрыва. Напр., при введении ионов меди в окисляющийся изопропиловый спирт цепи обрываются в результате протекания след. чередующихся р-ций:
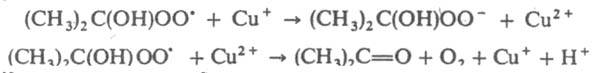
В таких системах наблюдаются периоды индукции, намного превышающие 2[И]0/vi. Для каждой р-ции существует специфич. набор И.: р-цию водорода с хлором тормозят NCl3 и О2, реагирующие с атомами хлора; полимеризацию виниловых мономеров -хиноны, нитросоединения, I2, стабильные радикалы (дифенилпикрилгидразил, нитроксильные радикалы), акцептирующие алкильные макрорадикалы; окисление орг соед. (углеводородов, каучуков и полиолефинов) фенолы, ароматич. амины, аминофенолы, реагирующие с пероксильными радикалами RO2; крекинг углеводородов олефины и оксиды азота, реагирующие с алкильными радикалами. Для тушения горения орг соед. используют галогенуглеводороды CF3Br, CF2ClBr, C2F4Br2. Их ингибирующее действие вызвано тем, что разветвляющими агентами при горении являются атомы Н, с к-рыми И. вступают в р-цию: RBr +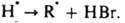 Образующийся НВr вызывает дополнит. обрыв цепей по р-циям:
Образующийся НВr вызывает дополнит. обрыв цепей по р-циям:
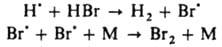
(М - любая третья частица). Для тушения горения применяют также огнегасящие порошки (напр.. NaHCO3, фосфорно-аммониевые соли), к-рые обладают комбинир. действием: снижают концентрацию радикалов из-за интенсивного обрыва цепей на пов-сти и вызывают повыш. теплоотвод (см. Горение). Различают слабые и сильные И. данной р-ции. Сильным считается такой И., к-рый, если его ввести в достаточно большой концентрации, сокращает длину цепи до единицы или уменьшает скорость р-ции в v0/vi раз, где v0 - исходная скорость р-ции. Слабый И., даже введенный в сравнительно высокой концентрации, снижает скорость р-ции от vi до нек-рого значения v > vi. Вызвано это тем, что из молекул слабого И. образуются радикалы, способные продолжать цепь, в силу чего отношение v0/v уменьшается с увеличением [И]0, не достигнув значения v0/vi. И., оказывающий сильное тормозящее действие в небольшой концентрации, наз. эффективным. Эффективность И. характеризуют значением производной —dv/d[И]. Напр., окисление углеводорода RH в присут. инициатора, создающего скорость инициирования vi, определяется скоростью продолжения цепи с участием пероксильного радикала:
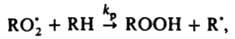
так что начальная скорость цепного окисления v = kp . [RH] [ ]. В присут. И., напр., фенола, цепи обрываются
по р-ции типа
]. В присут. И., напр., фенола, цепи обрываются
по р-ции типа 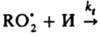 продукты. В квазистационарных
условиях скорости инициирования и обрыва равны: vi = fkt[И][RO2], поэтому [
продукты. В квазистационарных
условиях скорости инициирования и обрыва равны: vi = fkt[И][RO2], поэтому [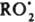 ] = vi/fkt [И] и v = kp[RH]vi/fkt [И]. Эффективность ингибирования характеризуется величиной отношения fkt/kp.
Для ингибирования цепных разветвленных р-ций характерны критич. явления, сущность к-рых состоит в резком снижении скорости р-ции при очень незначит. увеличении концентрации И. Примером может служить ингибир. автоокисление углеводородов RH, в к-ром осн. источником радикалов является продукт окисления ROOH. При достаточно высокой т-ре или в присут. катализатора, интенсивно превращающего ROOH в радикалы, окисление RH может протекать в квазистационарном режиме, когда скорость образования ROOH практически равна скорости его расходования. Т.к. скорость образования ROOH зависит и от концентрации И., и от концентрации ROOH, существует нек-рая критич. концентрация И., при к-рой система переходит от нестационарного к квазистационарному режиму при очень незначительном (на 0,1-1%) изменении концентрации И. Это выражается в резком изменении скорости р-ции или периода индукции И.
Два И., введенных в реагирующую систему, могут взаимно усилить ингибирующее действие друг друга (т. наз. синергизм И.) или ослабить его (антагонизм И.); нередко наблюдается и аддитивное действие двух И. Если t1 и t2 - длительности тормозящего действия первого и второго И., введенных порознь, а t12 - длительность их совместного действия, то в случае синергизма t12 > (t1 + t2), в случае антагонизма t12 < (t1 + t2). На диаграмме t - концентрация И. в случае синергизма наблюдается максимум. Синергизм И. может быть обусловлен либо разл. механизмами тормозящего действия И. (напр., при ингибир. окислении RH один И. обрывает цепи, а другой разрушает ROOH), либо хим. взаимодействием между двумя И. или продуктами их превращения.
] = vi/fkt [И] и v = kp[RH]vi/fkt [И]. Эффективность ингибирования характеризуется величиной отношения fkt/kp.
Для ингибирования цепных разветвленных р-ций характерны критич. явления, сущность к-рых состоит в резком снижении скорости р-ции при очень незначит. увеличении концентрации И. Примером может служить ингибир. автоокисление углеводородов RH, в к-ром осн. источником радикалов является продукт окисления ROOH. При достаточно высокой т-ре или в присут. катализатора, интенсивно превращающего ROOH в радикалы, окисление RH может протекать в квазистационарном режиме, когда скорость образования ROOH практически равна скорости его расходования. Т.к. скорость образования ROOH зависит и от концентрации И., и от концентрации ROOH, существует нек-рая критич. концентрация И., при к-рой система переходит от нестационарного к квазистационарному режиму при очень незначительном (на 0,1-1%) изменении концентрации И. Это выражается в резком изменении скорости р-ции или периода индукции И.
Два И., введенных в реагирующую систему, могут взаимно усилить ингибирующее действие друг друга (т. наз. синергизм И.) или ослабить его (антагонизм И.); нередко наблюдается и аддитивное действие двух И. Если t1 и t2 - длительности тормозящего действия первого и второго И., введенных порознь, а t12 - длительность их совместного действия, то в случае синергизма t12 > (t1 + t2), в случае антагонизма t12 < (t1 + t2). На диаграмме t - концентрация И. в случае синергизма наблюдается максимум. Синергизм И. может быть обусловлен либо разл. механизмами тормозящего действия И. (напр., при ингибир. окислении RH один И. обрывает цепи, а другой разрушает ROOH), либо хим. взаимодействием между двумя И. или продуктами их превращения.
Ингибирование гетерогенно-каталитических реакций осуществляется в-вами, к-рые наз. ядами каталитическими. Торможение р-ции обусловлено снижением активности катализатора вследствие адсорбции И. на его пов-сти.
Ингибирование ферментативных реакций м. б. обратимым и необратимым. В обоих случаях И. способен к образованию комплекса с ферментом, но не м. б. подвергнут каталитич. превращению и препятствует образованию комплекса фермент - субстрат. Напр., бутанол ингибирует гидролиз сложных эфиров, катализированный карбоксипептидазой. Различают след. случаи обратимого ингибирования. Прямое конкурентное ингибирование, при к-ром молекулы И. I и субстрата S конкурируют за присоединение к активному центру фермента Е. Процесс описывается соотношениями (Р - продукт превращения):
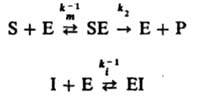
При таком механизме торможения, если [Е] << [S]0 и Е << [I]0, начальная скорость превращ. субстрата S равна:
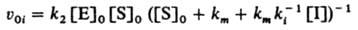
Неконкурентное ингибирование, при к-ром И. присоединяется к активному ферменту или комплексу фермента с субстратом с образованием каталитически неактивной формы:
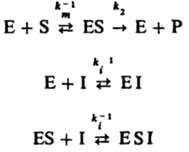
В этом случае начальная скорость р-ции равна:
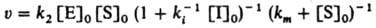
Внеконкурентное ингибирование, при к-ром И. образует каталитически неактивный комплекс с субстратом:
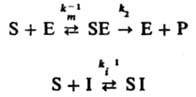
Начальная скорость р-ции равна:
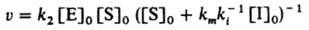
Отмечены случаи ингибирования фермента субстратом, когда неактивный комплекс с ферментом образует вторая молекула субстрата (субстратное ингибирование). Необратимо реагирующие И. реагируют с ферментом, дезактивируя его; в отличие от обратимого ингибирования активность фермента уменьшается во времени.
Применение. Ингибирование широко используется для регулирования скорости радикальной полимеризации, в частности при получении изделий большого объема. И. окисления используют для стабилизации полиолефинов и каучуков при их переработке и в условиях эксплуатации (см. Деструкция полимеров), для стабилизации смазочных материалов и углеводородных топлив, сохранения пищ. жиров и лек. препаратов; в технологии получения мономеров они используются для предотвращения окислит. полимеризации. В исследовательских работах И. применяются для изучения механизма цепных р-ций, в частности определения скорости инициирования. Лит.: Ашмор П., Катализ и ингибирование химических реакций, пер. с англ., М., 1966; Уэбб Л., Ингибиторы ферментов и метаболизма, пер. с англ., М., 1966; Кулиев А. М., Химия и технология присадок к маслам и топливам, М., 1972; Денисов Е.Т., Ковалев Г. И., Окисление и стабилизация реактивных топлив, М., 1983. Е. Т. Денисов.
Ингибирование цепных реакций. Длительность t тормозящего действия И. наз. периодом индукции; число цепей f, к-рые обрывает одна молекула И., последовательно вступая в р-ции обрыва, наз. стехиометрич. коэф. ингибирования. При исходной концентрации И. [И]0 и скорости инициирования цепей vi период индукции равен: t = f [И]0/vi. Напр., хинон тормозит полимеризацию виниловых мономеров, вступая в след. р-ции:

В этом случае f= 2 и t = 2[И]0/vi. В нек-рых системах происходит регенерация И. в р-циях обрыва цепи, в результате чего одна молекула И. и образующийся из нее радикал многократно участвуют в р-циях обрыва. Напр., при введении ионов меди в окисляющийся изопропиловый спирт цепи обрываются в результате протекания след. чередующихся р-ций:
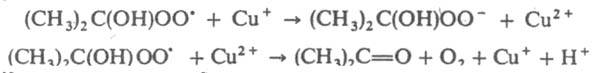
В таких системах наблюдаются периоды индукции, намного превышающие 2[И]0/vi. Для каждой р-ции существует специфич. набор И.: р-цию водорода с хлором тормозят NCl3 и О2, реагирующие с атомами хлора; полимеризацию виниловых мономеров -хиноны, нитросоединения, I2, стабильные радикалы (дифенилпикрилгидразил, нитроксильные радикалы), акцептирующие алкильные макрорадикалы; окисление орг соед. (углеводородов, каучуков и полиолефинов) фенолы, ароматич. амины, аминофенолы, реагирующие с пероксильными радикалами RO2; крекинг углеводородов олефины и оксиды азота, реагирующие с алкильными радикалами. Для тушения горения орг соед. используют галогенуглеводороды CF3Br, CF2ClBr, C2F4Br2. Их ингибирующее действие вызвано тем, что разветвляющими агентами при горении являются атомы Н, с к-рыми И. вступают в р-цию: RBr +
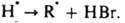 Образующийся НВr вызывает дополнит. обрыв цепей по р-циям:
Образующийся НВr вызывает дополнит. обрыв цепей по р-циям:
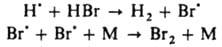
(М - любая третья частица). Для тушения горения применяют также огнегасящие порошки (напр.. NaHCO3, фосфорно-аммониевые соли), к-рые обладают комбинир. действием: снижают концентрацию радикалов из-за интенсивного обрыва цепей на пов-сти и вызывают повыш. теплоотвод (см. Горение). Различают слабые и сильные И. данной р-ции. Сильным считается такой И., к-рый, если его ввести в достаточно большой концентрации, сокращает длину цепи до единицы или уменьшает скорость р-ции в v0/vi раз, где v0 - исходная скорость р-ции. Слабый И., даже введенный в сравнительно высокой концентрации, снижает скорость р-ции от vi до нек-рого значения v > vi. Вызвано это тем, что из молекул слабого И. образуются радикалы, способные продолжать цепь, в силу чего отношение v0/v уменьшается с увеличением [И]0, не достигнув значения v0/vi. И., оказывающий сильное тормозящее действие в небольшой концентрации, наз. эффективным. Эффективность И. характеризуют значением производной —dv/d[И]. Напр., окисление углеводорода RH в присут. инициатора, создающего скорость инициирования vi, определяется скоростью продолжения цепи с участием пероксильного радикала:
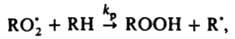
так что начальная скорость цепного окисления v = kp . [RH] [
 ]. В присут. И., напр., фенола, цепи обрываются
по р-ции типа
]. В присут. И., напр., фенола, цепи обрываются
по р-ции типа 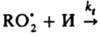 продукты. В квазистационарных
условиях скорости инициирования и обрыва равны: vi = fkt[И][RO2], поэтому [
продукты. В квазистационарных
условиях скорости инициирования и обрыва равны: vi = fkt[И][RO2], поэтому [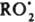 ] = vi/fkt [И] и v = kp[RH]vi/fkt [И]. Эффективность ингибирования характеризуется величиной отношения fkt/kp.
Для ингибирования цепных разветвленных р-ций характерны критич. явления, сущность к-рых состоит в резком снижении скорости р-ции при очень незначит. увеличении концентрации И. Примером может служить ингибир. автоокисление углеводородов RH, в к-ром осн. источником радикалов является продукт окисления ROOH. При достаточно высокой т-ре или в присут. катализатора, интенсивно превращающего ROOH в радикалы, окисление RH может протекать в квазистационарном режиме, когда скорость образования ROOH практически равна скорости его расходования. Т.к. скорость образования ROOH зависит и от концентрации И., и от концентрации ROOH, существует нек-рая критич. концентрация И., при к-рой система переходит от нестационарного к квазистационарному режиму при очень незначительном (на 0,1-1%) изменении концентрации И. Это выражается в резком изменении скорости р-ции или периода индукции И.
Два И., введенных в реагирующую систему, могут взаимно усилить ингибирующее действие друг друга (т. наз. синергизм И.) или ослабить его (антагонизм И.); нередко наблюдается и аддитивное действие двух И. Если t1 и t2 - длительности тормозящего действия первого и второго И., введенных порознь, а t12 - длительность их совместного действия, то в случае синергизма t12 > (t1 + t2), в случае антагонизма t12 < (t1 + t2). На диаграмме t - концентрация И. в случае синергизма наблюдается максимум. Синергизм И. может быть обусловлен либо разл. механизмами тормозящего действия И. (напр., при ингибир. окислении RH один И. обрывает цепи, а другой разрушает ROOH), либо хим. взаимодействием между двумя И. или продуктами их превращения.
] = vi/fkt [И] и v = kp[RH]vi/fkt [И]. Эффективность ингибирования характеризуется величиной отношения fkt/kp.
Для ингибирования цепных разветвленных р-ций характерны критич. явления, сущность к-рых состоит в резком снижении скорости р-ции при очень незначит. увеличении концентрации И. Примером может служить ингибир. автоокисление углеводородов RH, в к-ром осн. источником радикалов является продукт окисления ROOH. При достаточно высокой т-ре или в присут. катализатора, интенсивно превращающего ROOH в радикалы, окисление RH может протекать в квазистационарном режиме, когда скорость образования ROOH практически равна скорости его расходования. Т.к. скорость образования ROOH зависит и от концентрации И., и от концентрации ROOH, существует нек-рая критич. концентрация И., при к-рой система переходит от нестационарного к квазистационарному режиму при очень незначительном (на 0,1-1%) изменении концентрации И. Это выражается в резком изменении скорости р-ции или периода индукции И.
Два И., введенных в реагирующую систему, могут взаимно усилить ингибирующее действие друг друга (т. наз. синергизм И.) или ослабить его (антагонизм И.); нередко наблюдается и аддитивное действие двух И. Если t1 и t2 - длительности тормозящего действия первого и второго И., введенных порознь, а t12 - длительность их совместного действия, то в случае синергизма t12 > (t1 + t2), в случае антагонизма t12 < (t1 + t2). На диаграмме t - концентрация И. в случае синергизма наблюдается максимум. Синергизм И. может быть обусловлен либо разл. механизмами тормозящего действия И. (напр., при ингибир. окислении RH один И. обрывает цепи, а другой разрушает ROOH), либо хим. взаимодействием между двумя И. или продуктами их превращения.
Ингибирование гетерогенно-каталитических реакций осуществляется в-вами, к-рые наз. ядами каталитическими. Торможение р-ции обусловлено снижением активности катализатора вследствие адсорбции И. на его пов-сти.
Ингибирование ферментативных реакций м. б. обратимым и необратимым. В обоих случаях И. способен к образованию комплекса с ферментом, но не м. б. подвергнут каталитич. превращению и препятствует образованию комплекса фермент - субстрат. Напр., бутанол ингибирует гидролиз сложных эфиров, катализированный карбоксипептидазой. Различают след. случаи обратимого ингибирования. Прямое конкурентное ингибирование, при к-ром молекулы И. I и субстрата S конкурируют за присоединение к активному центру фермента Е. Процесс описывается соотношениями (Р - продукт превращения):
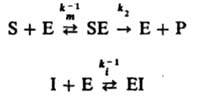
При таком механизме торможения, если [Е] << [S]0 и Е << [I]0, начальная скорость превращ. субстрата S равна:
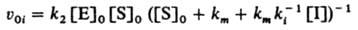
Неконкурентное ингибирование, при к-ром И. присоединяется к активному ферменту или комплексу фермента с субстратом с образованием каталитически неактивной формы:
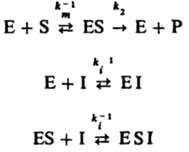
В этом случае начальная скорость р-ции равна:
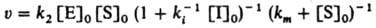
Внеконкурентное ингибирование, при к-ром И. образует каталитически неактивный комплекс с субстратом:
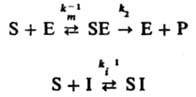
Начальная скорость р-ции равна:
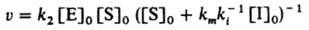
Отмечены случаи ингибирования фермента субстратом, когда неактивный комплекс с ферментом образует вторая молекула субстрата (субстратное ингибирование). Необратимо реагирующие И. реагируют с ферментом, дезактивируя его; в отличие от обратимого ингибирования активность фермента уменьшается во времени.
Применение. Ингибирование широко используется для регулирования скорости радикальной полимеризации, в частности при получении изделий большого объема. И. окисления используют для стабилизации полиолефинов и каучуков при их переработке и в условиях эксплуатации (см. Деструкция полимеров), для стабилизации смазочных материалов и углеводородных топлив, сохранения пищ. жиров и лек. препаратов; в технологии получения мономеров они используются для предотвращения окислит. полимеризации. В исследовательских работах И. применяются для изучения механизма цепных р-ций, в частности определения скорости инициирования. Лит.: Ашмор П., Катализ и ингибирование химических реакций, пер. с англ., М., 1966; Уэбб Л., Ингибиторы ферментов и метаболизма, пер. с англ., М., 1966; Кулиев А. М., Химия и технология присадок к маслам и топливам, М., 1972; Денисов Е.Т., Ковалев Г. И., Окисление и стабилизация реактивных топлив, М., 1983. Е. Т. Денисов.
Иванова реакция
Игданит
Идеальный газ
Идентификация
Изатин
Изафенин
Избирательность анализа
Известковые удобрения
Известняк
Известь
Измельчение
Изо..
Изоmeризat
Изоамилацетат
Изоамиловый спирт
Изобутилен
Изобутиловый спирт
Изовалериановая кислота
Изовалериановый альдегид
Изоиндол
Изоксазол
Изолейцин
Изолированная система
Изолобальной аналогии принцип
Изоляционные масла
Изомасляный альдегид
Изомеразы
Изомеризация
Изомерия
Изомерия атомных ядер
Изоморфизм
Изоникотиновая кислота
Изонитрилы
Изонитрильные комплексы переходных металлов
Изопрен
Изопреновые каучуки синтетические
Изопреноиды
Изопропаноламины
Изопропилбензол
Изопропиловый спирт
Изотактические полимеры
Изотахофорез
Изотиазол
Изотиоцианаты
Изотопного разбавления метод
Изотопные генераторы
Изотопные индикаторы
Изотопные эффекты
Изотопный анализ
Изотопный обмен
Изотопов разделение
Изотопы
Изоферменты
Изофталевая кислота
Изофталоилхлорид
Изохинолин
Изохинолиновые алкалоиды
Изоцианаты
Изоцианаты блокированные
Изоцинхомероновая кислота
Изоцитрат-лиаза
Изоэвгенол
Изоэлектрическая точка
Изумрудная зелень
Илиды
Имид-амидная перегруппировка
Имидазол
Имидазолины
Имидофосфаты
Имиды карболовых кислот
Имиды металлов
Имизин
Иминиевые соли
Иминоксильные радикалы
Иминоэфиры
Иммерсионные жидкости
Иммобилизованные ферменты
Иммуномодулирующие средства
Иммунохимия
Импедансный метод
Импульсный радиолиз
Импульсный фотолиз
Ингибиторы
Ингибиторы коррозии
Индазол
Индамины
Индан
Индандионы
Индантрон
Инден
Индиго
Индигоидные красители
Индигокармин
Индий
Индикаторная бумага
Индикаторные трубки
Индикаторы
Индия антимонид
Индия арсенид
Индия галогениды
Индия оксиды
Индия фосфид
Индоанилины
Индоксан
Индол
Индольные алкалоиды
Индофенолы
Индуктивный эффект
Индукция химическая
Индулины
Индустриальные масла
Инженерная энзимология
Инициаторы радикальные
Инициирование
Инициирующие взрывчатые вещества
Инкапаситанты
Инозин
Инозиты
Инсектициды
Инсулин
Интенсивные параметры
Интеркалаты
Интерлейкины
Интермедиат
Интерметаллиды
Интерфероны
Инулин
Инфразвуковые аппараты
Инфракрасная спектроскопия
Иод
Иодбензол
Иодиды
Иодное число
Иодные удобрения
Иодозобензол
Иодометрия
Ион-молекулярные комплексы
Ион-радикалы
Ион-циклотронный резонанс
Ионизации потенциал
Ионизирующие излучения
Иониты
Ионная атмосфера
Ионная имплантация
Ионная полимеризация
Ионная хроматография
Ионно-молекулярные реакции
Ионного рассеяния спектроскопия
Ионные кристаллы
Ионные пары
Ионные радиусы
Ионный выход
Ионный микроанализ
Ионный обмен
Ионол
Иономеры
Ионометрия
Иононы
Ионообменная хроматография
Ионообменные смолы
Ионоселективные электроды
Ионофоры
Ионы
Ионы в газах
Иоцича реакция
Иприт
Ипсо-замещение
Иридий
Иридийорганические соединения
Ирисаль
Ирританты
Искусственная пища
Искусственные волокна
Искусственный интеллект
Испарение
Итаконовая кислота
Иттербий
Иттрий
Ихтиоциды
Июпак

